Периодическая система химических элементов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы). В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико-химические свойства, а строки представляют собой периоды, в определённой мере подобные друг другу.
Классический вид таблицы Менделеева
История открытия Периодического закона.
К середине XIX века были открыты 63 химических элемента, и попытки найти закономерности в этом наборе предпринимались неоднократно.
В 1829 году Дёберейнер опубликовал найденный им «закон триад»: атомный вес многих элементов близок к среднему арифметическому двух других элементов, близких к исходному по химическим свойствам (стронций, кальций и барий; хлор, бром и йод и др.). Первую попытку расположить элементы в порядке возрастания атомных весов предпринял Александр Эмиль Шанкуртуа (1862), который разместил элементы вдоль винтовой линии и отметил частое циклическое повторение химических свойств по вертикали. Обе указанные модели не привлекли внимания научной общественности.
В 1866 году свой вариант периодической системы предложил химик и музыкант Джон Александр Ньюлендс, модель которого («закон октав») внешне немного напоминала менделеевскую, но была скомпрометирована настойчивыми попытками автора найти в таблице мистическую музыкальную гармонию. В этом же десятилетии появились ещё несколько попыток систематизации химических элементов; ближе всего к окончательному варианту подошёл Юлиус Лотар Мейер (1864). Д. И. Менделеев опубликовал свою первую схему периодической таблицы в 1869 году в статье «Соотношение свойств с атомным весом элементов» (в журнале Русского химического общества); ещё ранее (февраль 1869 г.) научное извещение об открытии было им разослано ведущим химикам мира.
По легенде, мысль о системе химических элементов пришла к Менделееву во сне, однако известно, что однажды на вопрос, как он открыл периодическую систему, учёный ответил: «Я над ней, может быть, двадцать лет думал, а вы думаете: сидел и вдруг… готово».
Написав на карточках основные свойства каждого элемента (их в то время было известно 63, из которых один — дидим Di — оказался в дальнейшем смесью двух вновь открытых элементов празеодима и неодима), Менделеев начинает многократно переставлять эти карточки, составлять из них ряды сходных по свойствам элементов, сопоставлять ряды один с другим. Итогом работы стал отправленный в 1869 году в научные учреждения России и других стран первый вариант системы («Опыт системы элементов, основанной на их атомном весе и химическом сходстве»), в котором элементы были расставлены по девятнадцати горизонтальным рядам (рядам сходных элементов, ставших прообразами групп современной системы) и по шести вертикальным столбцам (прообразам будущих периодов). В 1870 году Менделеев в «Основах химии» публикует второй вариант системы («Естественную систему элементов»), имеющий более привычный нам вид: горизонтальные столбцы элементов-аналогов превратились в восемь вертикально расположенных групп; шесть вертикальных столбцов первого варианта превратились в периоды, начинавшиеся щелочным металлом и заканчивающиеся галогеном. Каждый период был разбит на два ряда; элементы разных вошедших в группу рядов образовали подгруппы.
Сущность открытия Менделеева заключалась в том, что с ростом атомной массы химических элементов их свойства меняются не монотонно, а периодически. После определённого количества разных по свойствам элементов, расположенных по возрастанию атомного веса, свойства начинают повторяться. Например, натрий похож на калий, фтор похож на хлор, а золото похоже на серебро и медь. Разумеется, свойства не повторяются в точности, к ним добавляются и изменения. Отличием работы Менделеева от работ его предшественников было то, что основ для классификации элементов у Менделеева была не одна, а две — атомная масса и химическое сходство. Для того, чтобы периодичность полностью соблюдалась, Менделеевым были предприняты очень смелые шаги: он исправил атомные массы некоторых элементов (например, бериллия, индия, урана, тория, церия, титана, иттрия), несколько элементов разместил в своей системе вопреки принятым в то время представлениям об их сходстве с другими (например, таллий, считавшийся щелочным металлом, он поместил в третью группу согласно его фактической максимальной валентности), оставил в таблице пустые клетки, где должны были разместиться пока не открытые элементы. В 1871 году на основе этих работ Менделеев сформулировал Периодический закон, форма которого со временем была несколько усовершенствована.
Научная достоверность Периодического закона получила подтверждение очень скоро: в 1875—1886 годах были открыты галлий (экаалюминий), скандий (экабор) и германий (экасилиций), для которых Менделеев, пользуясь периодической системой, предсказал не только возможность их существования, но и, с поразительной точностью, целый ряд физических и химических свойств.
Список химических элементов таблицы Менделеева
- 1 H Водород (а.м. 1,00794)
- 2 He Гелий (а.м. 4,002602)
- 3 Li Литий (а.м. 6,9412)
- 4 Be Бериллий (а.м. 9,0122)
- 5 B Бор (а.м. 10,812)
- 6 С Углерод (а.м. 12,011)
- 7 N Азот (а.м. 14,0067)
- 8 О Кислород (а.м. 15,9994)
- 9 F Фтор (а.м. 18,9984)
- 10 Ne Неон (а.м. 20,179)
- 11 Na Натрий (а.м. 22,98977)
- 12 Mg Магний (а.м. 24,305)
- 13 Al Алюминий (а.м. 26,98154)
- 14 Si Кремний (а.м. 28,086)
- 15 P Фосфор (а.м. 30,97376)
- 16 S Сера (а.м. 32,06)
- 17 Cl Хлор (а.м. 35,453)
- 18 Ar Аргон (а.м. 39,948)
- 19 К Калий (а.м. 39,0983)
- 20 Ca Кальций (а.м. 40,08)
- 21 Sc Скандий (а.м. 44,9559)
- 22 Ti Титан (а.м. 47,9)
- 23 V Ванадий (а.м. 50,9415)
- 24 Cr Хром (а.м. 51,996)
- 25 Mn Марганец (а.м. 54,938)
- 26 Fe Железо (а.м. 55,847)
- 27 Со Кобальт (а.м. 58,9332)
- 28 Ni Никель (а.м. 58,7)
- 29 Cu Медь (а.м. 63,546)
- 30 Zn Цинк (а.м. 65,38)
- 31 Ga Галлий (а.м. 69,72)
- 32 Ge Германий (а.м. 72,59)
- 33 As Мышьяк (а.м. 74,9216)
- 34 Se Селен (а.м. 78,96)
- 35 Br Бром (а.м. 79,904)
- 36 Kr Криптон (а.м. 83,8)
- 37 Rb Рубидий (а.м. 85,4678)
- 38 Sr Стронций (а.м. 87,62)
- 39 Y Иттрий (а.м. 88,9059)
- 40 Zr Цирконий (а.м. 91,20)
- 41 Nb Ниобий (а.м. 92,9064)
- 42 Mo Молибден (а.м. 95,94)
- 43 Tc Технеций (а.м. 98,9062)
- 44 Ru Рутений (а.м. 101,07)
- 45 Rh Родий (а.м. 102,9055)
- 46 Pd Палладий (а.м. 106,4)
- 47 Ag Серебро (а.м. 107,868)
- 48 Cd Кадмий (а.м. 112,41)
- 49 In Индий (а.м. 114,82)
- 50 Sn Олово (а.м. 118,69)
- 51 Sb Сурьма (а.м. 121,75)
- 52 Те Теллур (а.м. 127,6)
- 53 I Йод (а.м. 126,9045)
- 54 Xe Ксенон (а.м. 131,3)
- 55 Cs Цезий (а.м. 132,9054)
- 56 Ba Барий (а.м. 137,33)
- 57 La Лантан (а.м. 138,9)
- 58 Ce Церий (а.м. 140,12)
- 59 Pr Празеодим (а.м. 140,9)
- 60 Nd Неодим (а.м. 144,24)
- 61 Pm Прометий (а.м. 145)
- 62 Sm Самарий (а.м. 150,35)
- 63 Eu Европий (а.м. 151,96)
- 64 Gd Гадолиний (а.м. 157,25)
- 65 Tb Тербий (а.м. 158,92)
- 66 Dy Диспрозий (а.м. 162,5)
- 67 Ho Гольмий (а.м. 164,93)
- 68 Er Эрбий (а.м. 167,26)
- 69 Tm Тулий (а.м. 168,93)
- 70 Yb Иттербий (а.м. 173,04)
- 71 Lu Лютеций (а.м. 174,97)
- 72 Hf Гафний (а.м. 178,49)
- 73 Ta Тантал (а.м. 180,9479)
- 74 W Вольфрам (а.м. 183,85)
- 75 Re Рений (а.м. 186,207)
- 76 Os Осмий (а.м. 190,2)
- 77 Ir Иридий (а.м. 192,22)
- 78 Pt Платина (а.м. 195,09)
- 79 Au Золото (а.м. 196,9665)
- 80 Hg Ртуть (а.м. 200,59)
- 81 Tl Таллий (а.м. 204,37)
- 82 Pb Свинец (а.м. 207,2)
- 83 Bi Висмут (а.м. 208,9)
- 84 Po Полоний (а.м. 209)
- 85 At Астат (а.м. 210)
- 86 Rn Радон (а.м. 222)
- 87 Fr Франций (а.м. 223)
- 88 Ra Радий (а.м. 226)
- 89 Ac Актиний (а.м. 227)
- 90 Th Торий (а.м. 232,03)
- 91 Pa Протактиний (а.м. 231,03)
- 92 U Уран (а.м. 238,02)
- 93 Np Нептуний (а.м. 237,04)
- 94 Pu Плутоний (а.м. 244,06)
- 95 Am Америций (а.м. 243,06)
- 96 Cm Кюрий (а.м. 247,07)
- 97 Bk Берклий (а.м. 247,07)
- 98 Cf Калифорний (а.м. 251,07)
- 99 Es Эйнштейний (а.м. 252,08)
- 100 Fm Фермий (а.м. 257,08)
- 101 Md Менделевий (а.м. 258,09)
- 102 No Нобелий (а.м. 259,1)
- 103 Lr Лоуренсий (а.м. 260,1)
- 104 Rf Резерфордий (а.м. 261)
- 105 Db Дубний (а.м. 262)
- 106 Sg Сиборгий (а.м. 266)
- 107 Bh Борий (а.м. 267)
- 108 Hs Хассий (а.м. 269)
- 109 Mt Мейтнерий (а.м. 276)
- 110 Ds Дармштадтий (а.м. 227)
- 111 Rg Ренгений (а.м. 280)
- 112 Cn Коперниций (а.м. 285)
- 113 Uut Унунтрий (а.м. 284)
- 114 Uuq Унунквадий (а.м. 289)
- 115 Uup Унунпентий (а.м. 288)
- 116 Uuh Унунгексий (а.м. 293)
- 117 Uus Унунсептий (а.м. 294)
- 118 Uuo Унуноктий (а.м. 294)
- 119 Uuе Унуненний (а.м. 316)
- 120 Ubn Унбинилий (а.м. 320)
- 121 Ubu Унбиуний (а.м. 320)
- 122 Ubb Унбибий
- 123 Ubt Унбитрий
- 124 Ubq Унбиквадий
- 125 Ubp Унбипентий (а.м. 332)
- 126 Ubn Унбигексий (а.м. 322)
Другие заметки по химии
Таблица Менделеева (периодическая система химических элементов) — это такая таблица, в которой классифицируются химические элементы по различным свойствам в зависимости от заряда их атомного ядра. Таблица является графическим изображением периодического закона, который открыл Дмитрий Иванович Менделеев в 1869 году. Изначальный вариант этой таблицы 1869 — 1871 гг. и устанавливал зависимость свойств элементов от их атомной массы. На данный момент элементы сводятся в двумерную таблицу, в которой каждый столбец — это группа, определяющая основные физико-химические свойства, а строки — это периоды, схожие друг с другом. Наиболее распространены 2 формы таблицы: короткая и длинная.
ТАБЛИЦА МЕНДЕЛЕЕВА

Порядковый номер элемента — это число равное числу протонов в ядре атома и числу электронов, которые вращаются вокруг него.
Чтобы посмотреть все свойства конкретного химического элемента нужно перейти по ссылке нажав на символ элемента в таблице.
| П. | Группы химических элементов | |||||||||
| VIII | ||||||||||
| 1 | 1,00794 Водород | 4,0026 Гелий | ||||||||
| 2 | 6,941 Литий | 9,0122 Берилий | 10,811 Бор | 12,01115 Углерод | 14,0067 Азот | 15,9994 Кислород | 18,9984 Фтор | 20,179 Неон | ||
| 3 | 22,9898 Натрий | 24,305 Магний | 26,9815 Алюминий | 28,086 Кремний | 30,9738 Фосфор | 32,064 Сера | 35,454 Хлор | 39,948 Аргон | ||
| 4 | 39,0983 Калий | 40,08 Кальций | 44,956 Скандий | 47,88 Титан | 50,942 Ванадий | 51,996 Хром | 54,938 Марганец | 55,847 Железо | 58,9332 Кобальт | 58,69 Никель |
| 63,546 Медь | 65,39 Цинк | 69,72 Галлий | 72,61 Германий | 74,9216 Мышьяк | 78,96 Селен | 79,904 Бром | 83,80 Криптон | |||
| 5 | 85,47 Рубидий | 87,62 Стронций | 88,906 Иттрий | 91,224 Цирконий | 92,906 Ниобий | 95,94 Молибден | 98,906 Технеций | 101,07 Рутений | 102,905 Родий | 106,42 Палладий |
| 107,868 Серебро | 112,41 Кадмий | 114,82 Индий | 118,71 Олово | 121,75 Сурьма | 127,60 Теллур | 126,9045 Йод | 131,30 Ксенон | |||
| 6 | 132,905 Цезий | 137,327 Барий | 138,91 Лантан | 178,49 Гафний | 180,948 Тантал | 183,85 Вольфрам | 186,207 Рений | 190,2 Осмий | 192,22 Иридий | 195,09 Платина |
| 196,967 Золото | 200,59 Ртуть | 204,383 Таллий | 207,19 Свинец | 208,98 Висмут | [209] Полоний | [210] Астат | [222] Радон | |||
| 7 | [223] Франций | 226,025 Радий | [227] Актиний | [261] Резерфордий | [262] Дубний | [263] Сиборгий | [264] Борий | [265] Хассий | [266] Мейтнерий | [281] Дармштадтий |
| [281] Рентгений | [285] Коперниций | [284] Нихоний | [289] Флеровий | [288] Московий | [293] Ливерморий | [294] Теннесин | [294] Оганесон | |||
| 8 | [316] Унуненний | [320] Унбинилий | ||||||||
| Высшие оксиды | ||||||||||
| R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | RO4 | |||
| Летучие водородные соединения | ||||||||||
| RH4 | RH3 | H2R | RH | |||||||
| * ЛАНТАНОИДЫ | |||||||||
| 114,16 Церий | 140,907 Празеодим | 144,24 Неодим | [145] Прометий | 150,36 Самарий | 151,96 Европий | 157,25 Гадолиний | 158,924 Тербий | 162,5 Диспрозий | 164,93 Гольмий |
| 167,26 Эрбий | 168,94 Тулий | 173,04 Иттербий | 174,97 Лютеций | ||||||
| ** АКТИНОИДЫ | |||||||||
| 232,038 Торий | 231,04 Протактиний | 238,03 Уран | 237,05 Нептуний | [244] Плутоний | [243] Америций | [247] Кюрий | [247] Берклий | [251] Калифорний | [254] Эйнштейний |
| [257] Фермий | [258] Менделевий | [259] Нобелий | 260 Лоуренсий | ||||||
| *** СУПЕРАКТИНОИДЫ | |||||||||
| 320 Унбиуний | * Унбибий | * Унбитрий | 332 Унбиквадий | * Унбипентий | * Унбигексий | ||||
| s – элементы | p – элементы | d – элементы | f – элементы |
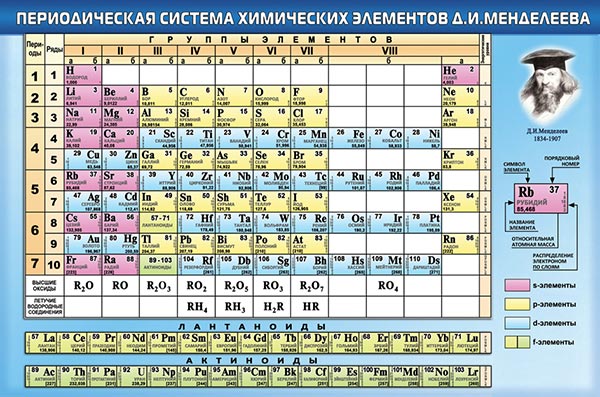
Периодическая система химических элементов Д.И. Менделеева
Расшифровка периодической системы химических элементов Д.И. Менделеева:
Периоды – горизонтальные строки химических элементов.
Группы – вертикальные столбцы химических элементов.
Подгруппы – А — главные (s- и р-элементы) и В — побочные (d- и f-элементы).
Номер периода – номер внешнего энергетического уровня в электронной формуле атома элемента.
Номер группы (для большинства элементов) – общее число валентных электронов (электронов внешнего энергетического уровня, а также предпоследнего d-подуровня, если он застроен не полностью).
Число элементов в периоде – максимальная емкость соответствующего энергетического уровня:
| 1 период | 2 элемента (1s2) | 5 период | 18 элементов (5s24d105p6) |
| 2 период | 8 элементов (2s22p6) | 6 период | 32 элемента (6s24f145d106p6) |
| 3 период | 8 элементов (3s23p6) | 7 период | 32 элемента (6s24f145d106p6) |
| 4 период | 18 элементов (4s23d104p6) | 8 период | не завершен |
Построение периодов – в начале: два s-элемента, в конце: шесть р- элементов. В четвертом и пятом периодах между ними помещается по десять d-элементов, а в шестом и седьмом к ним добавляются четырнадцать f-элементов (формы электронных орбиталей).
В периоде – свойства химических элементов различаются между собой, т.к. электронные конфигурации валентных электронов их атомов различны.
В подгруппе – свойства элементов сходны между собой, т.к. электронные конфигурации валентных электронов их атомов сходны.
Причина периодичности свойств химических элементов заключается в периодической повторяемости сходных электронных конфигураций внешних энергетических уровней.
Формы электронных орбиталей (электронные семейства)
Классификация химических элементов по электронным конфигурациям их атомов (электронные орбитали)
| Название семейства | Тип конфигурации | Застраиваемые подуровни |
| s — элементы | ns1–2 | внешний (n) s-подуровень |
| p -элементы | ns2 np1–6 | внешний (n) р-подуровень |
| d — элементы | (n-1)d1–10 ns1–2 | предвнешний (n–1 ) d-подуровень |
| f — элементы | (n-2)f1–14 (n-1)d1–10 ns1–2 | третий снаружи (n–2) f-подуровень |
Графическое изображение орбиталей
Свойства элементов таблицы Менделеева
Металлы – элементы главных подгрупп с числом валентных электронов от 1 до 3 (подгруппы IA, IIA, IIIА, кроме элемента бора), а также германий, олово, свинец, сурьма, висмут и полоний.
Неметаллы – бор и элементы главных подгрупп с числом валентных электронов от 4 до 7 (подгруппы IVA, VA, VIA, VIIA) кроме германия, олова, свинца, сурьмы, висмута и полония.
Переходные элементы – элементы побочных подгрупп (IB-VIIB); в виде простых веществ ведут себя как металлы.
Благородные газы – элементы подгруппы VIIIA, полностью застроенные энергетические подуровни s2p6, для гелия s2.
Галогены – элементы подгруппы VII(a) таблицы Менделеева, реагируют со всеми простыми веществами, кроме некот. неметаллов, являются энергичными окислителями, к ним относят F, Cl, Br, I, At, Ts.
Лантанойды – 15 элементов III группы 6-го периода, металлы с атомными номерами 57–71. Все они имеют стабильные изотопы, кроме прометия.
Актинойды – 15 радиоактивных элементов III группы 7-го периода с атомными номерами 89–103.
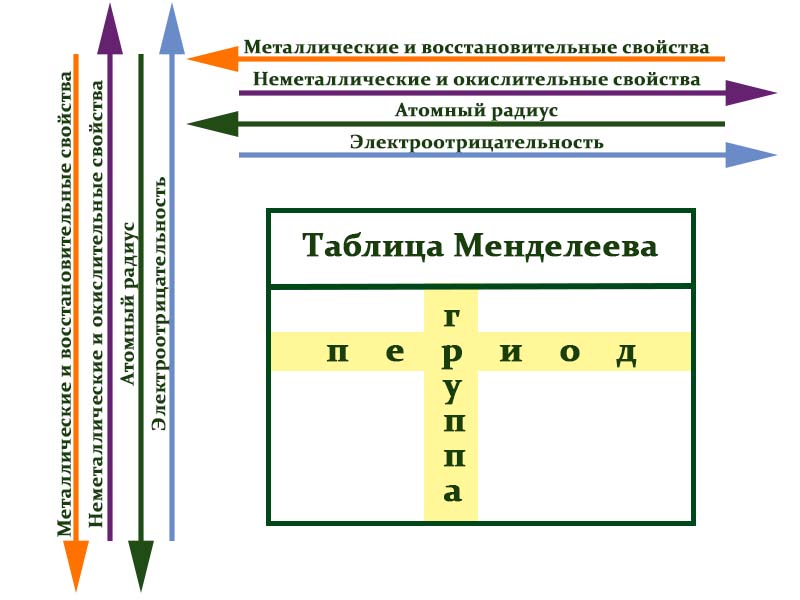
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
— металлические свойства усиливаются и неметаллические свойства ослабевают;
— атомный радиус увеличивается;
— возрастает сила образованных элементом оснований и бескислородных кислот;
— уменьшается электроотрицательность.
В периодах с увеличением порядкового номера элемента прослеживается следующая закономерность:
— увеличивается электроотрицательность;
— металлические свойства ослабевают, неметаллические усиливаются;
— уменьшается атомный радиус.
Все элементы таблицы Менделеева, исключая гелий, неон и аргон, образуют кислородные соединения, которые изображены общими формулами под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где R — обозначает элемент группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения: RH4, RH3, RH2, RH. Соединения RH4 имеют нейтральный характер; RH3 – слабоосновной; RH2 – слабокислый; RH – сильнокислый характер.
История открытия периодического закона Менделеевым Д.И.
Самый важный вклад в систематизацию химических элементов внёс русский выдающийся химик Дмитрий Иванович Менделеев, автор труда «Основы химии», который в марте 1869 года представил Русскому химическому обществу (РХО) периодический закон химических элементов, изложенный в нескольких основных положениях.
В 1871 году Менделеев в итоговой статье «Периодическая законность химических элементов» дал формулировку Периодического закона: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от атомного веса». Тогда же Менделеев придал своей периодической таблице классический вид (короткая таблица, смотрите ниже).
В современном изложении периодический закон химических элементов звучит так: «Свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).»
Периодическая таблица элементов Менделеева длинная форма
Длинная форма таблицы Менделеева (или длиннопериодная форма) состоит из 18 групп с лева на право от щелочных металов до благородных газов. считается официальной версией с 1989 года.
Таблица Менделеева для печати в хорошем качестве скачать
Вы можете скачать таблицу Менделеева на выбор короткую или длинную форму в цветном и черно-белом цвете, для этого откройте по ссылке ниже изображение и сохраните его себе на компьютер.
1) Таблица Менделеева для печати в хорошем качестве цветная (короткая форма)
2) Таблица Менделеева для печати в хорошем качестве черно-белая (короткая форма)
3) Таблица Менделеева для печати в хорошем качестве цветная (длинная форма)
4) Таблица Менделеева для печати в хорошем качестве черно-белая (длинная форма)
____________
Источник информации:
1. Большой химический справочник / А.И.Волков, — М.: 2005.
2. Большая энциклопедия химических элементов. Периодическая таблица Менделеева / И.А.Леенсон. — Москва : 2014.
3. По материалам сайта ru.wikipedia.org
Откуда происходят названия и символы химических элементов? Уже в Древнем Египте для обозначения некоторых веществ использовали символические изображения, которые выражали целые слова или понятия (рис. 5.7).
В средние века количество алхимических символов достигло нескольких тысяч. А для одного и того же вещества существовали десятки разных знаков.
Символ химического элемента — его условное обозначение.
Во второй половине XVIII в. ученые делали напрасные попытки упорядочить химические знаки. Обозначить каждое вещество отдельным символом не удавалось из-за открытия многих новых веществ. Поэтому со временем старинную алхимическую символику заменили химическими знаками, предложенными английским химиком Дж. Дальтоном. В символике Дальтона атом каждого элемента изображен кружком. На поле изображения обозначены либо черточки и точки, либо начальные буквы английских названий элементов. Буквенная система химических знаков является удобным способом записи, хранения и передачи химической информации.
 |
| Рис. 5.7. Химические символы разных времен |
Знаки Дальтона, хотя и имели определенное распространение, но были неудобны для печатания. Поэтому в 1814 г. шведский ученый Й.Я. Берцелиус предложил только буквенную систему знаков. Знаки элементов составлялись или из первой буквы их латинских названий, или из первой и одной из последующих букв. Так Берцелиус добился максимально возможного сближения символа химического элемента с его названием.
| Латинское название химического элемента | Символ | ||
| алхимический | по Дж. Дальтону | по Й. Я. Берцелиусу | |
| Aurum | | | Au |
| Hydrargyrum | | | Hg |
| Plumbum | | | Pb |
Таблица. Названия и символы некоторых химических элементов
| Символ | Произношение | Латинское название | Современное название | |
| русское | украинское | |||
| Н | Аш | Hydrogenium | водород | Гідроген |
| С | Цэ | Carboneum | углерод | Карбон |
| N | Эн | Nitrogenium | азот | Нітроген |
| О | О | Oxygenium | кислород | Оксиген |
| F | Фтор | Fluorum | фтор | Флуор |
| Na | Натрий | Natrium | натрий | Натрій |
| Mg | Магний | Magnesium | магний | Магній |
| A1 | Алюминий | Aluminium | алюминий | Алюміній |
| Si | Силиций | Silicium | кремний | Силіцій |
| P | Пэ | Phoshorus | фосфор | Фосфор |
| S | Эс | Sulfur | сера | Сульфур |
| Cl | Хлор | Clorum | хлор | Хлор |
| к | Калий | Kalium | калий | Калій |
| Ca | Кальций | Calcium | кальций | Кальцій |
| Fe | Феррум | Ferrum | железо | Ферум |
| Cu | Купрум | Cuprum | медь | Купрум |
| Zn | Цинк | Zinkum | цинк | Цинк |
| Ag | Аргентум | Argentum | серебро | Аргентум Материал с сайта http://worldofschool.ru |
| Sn | Станум | Stannum | олово | Станум |
| Pb | Плюмбум | Plumbum | свинец | Плюмбум |
| Au | Аурум | Aurum | золото | Аурум |
| Hg | Гидраргирум | Hydrargyrum | ртуть | Меркурій |
| I | Йод | Iodum | йод | Йод |
Проанализируй данные, приведенные в таблице. Сравни современные русские и украинские названия химических элементов. Определи, какие из них непосредственно происходят от латинских названий.
Запомни, что русские названия химических элементов — нарицательные, их пишут со строчной буквы. Современные украинские названия химических элементов являются собственными, поэтому их пишут с прописной буквы. И в том и в другом случае нельзя в устной речи заменять название химического элемента произношением его символа. Не следует также заменять название элемента его символом в рукописях или печатных текстах.

-
Произношение oxygenium
-
Произношение химических элементов 7 класс
-
Химическое произношение химических элементов
-
Все химические элементы список с произношением и с символами
-
Химические элементы с произношением на русском

-
Почему буквенная система химических знаков сохранилась до наших дней?
 В статье рассмотрена расшифровка таблицы Менделеева, с помощью которой можно быстро в ней разобраться. Из таблицы Менделеева можно почерпнуть огромное количество информации о каждом химическом элементе. Ее можно использовать на ЕГЭ, если уметь грамотно ей пользоваться.
В статье рассмотрена расшифровка таблицы Менделеева, с помощью которой можно быстро в ней разобраться. Из таблицы Менделеева можно почерпнуть огромное количество информации о каждом химическом элементе. Ее можно использовать на ЕГЭ, если уметь грамотно ей пользоваться.
- Периодическая система Менделеева систематизирует элементы и их свойства. В ней все элементы упорядочены с учетом их атомного числа и повторяющихся химических свойств.
- Периодический закон: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Расшифровка обозначений элементов
Каждому химическому элементу в таблице отведена одна клеточка, в которой указаны символ и название элемента, порядковый номер и относительная атомная масса.
Расшифровка обозначений элементов таблицы Менделеева:
- Обозначение: одной или двумя латинскими буквами.
- Порядковый номер элемента или атомный номер равен числу протонов в его ядре. Обычно пишется в левом верхнем углу.
- Относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учетом их содержания в природе. Поэтому обычно она является дробным числом.
- Если округлить атомную массу до ближайшего целого, мы получим так называемое массовое число.
- Разность массового числа и атомного числа дает количество нейтронов в ядре. Так, число нейтронов в ядре гелия равно двум, а у лития – четырем.
- Число положительных протонов, как правило, равно числу отрицательных электронов в атоме (за исключением изотопов).
- Электронная конфигурация — формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы.
-
Чтобы узнать количество нейтронов в ядре элемента, необходимо из относительной атомной массы (массового числа) вычесть порядковый номер.
Элементы периодической таблицы Менделеева
Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
- Металлы обладают хорошей электро- и теплопроводностью, способны отражать яркий свет, имеют высокую температуру плавления (остаются твердыми при нормальных значениях окружающей среды, исключение — ртуть).
- Неметаллы встречаются в природе в трех состояниях: газ (например, водород), жидкость (например, бром) и твердые вещества (например, фосфор). Он не способны проводить тепло и электричество. Имеют более низкую температуру плавления в сравнении с металлами, более хрупкие и ломкие. Могут иметь разнообразный внешний вид (элементы с низкой плотностью и яркостью).
- Металлоиды имеют смешанные свойства металлов и неметаллов (например, кремний). Они имеют среднюю тепло- и электропроводность. Различаются между собой по температуре плавления, плотности, цвету и форме. Внешний вид может быть схож с металлами или неметаллами.
Расшифровка групп и периодов таблицы Менделеева
В таблице химические вещества расположены в специальном порядке: слева направо по мере роста их атомных масс. Все они в периодической системе объединены в периоды и группы.
Периоды — это горизонтальные ряды в таблице. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Номер периода, в котором находится элемент, совпадает с номером его валентной оболочки. Эта валентная оболочка постепенно заполняется от начала к концу периода.
Закономерности периодов:
- Металлические свойства убывают, неметаллические и окислительные -возрастают. Каждый период начинается активным металлом и заканчивается инертным газом.
- Уменьшается атомный радиус.
- Увеличивается электроотрицательность.
Группы — это столбцы. Элементы во всех группах имеют одинаковое электронное строение внешних электронных оболочек. В каждой группе на внешнем энергетическом атома одинаковое число электронов, то есть номер группы совпадает с числом валентных электронов, которые могут участвовать в образовании химических связей. Поэтому номер группы часто совпадает с валентностью элементов. Например, номер группы совпадает с валентностью s-элементов и с наибольшей возможной валентностью p-элементов.
Закономерности групп:
- Металлические свойства увеличиваются, неметаллические и окислительные- убывают.
- Увеличивается радиус атома элементов в рамках одной группы.
- Уменьшается электроотрицательность.
Атомное число показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Валетность — это свойство элементов образовывать химические связи. То есть это количество химических связей, которые образует атом или число атомов, которое может присоединить или заместить атом данного элемента. Валентность бывает: постоянная и переменная (зависит от состава вещества, в которое входит элемент).
Определить валентность:
— Постоянная валентность идентична номеру группы главной подгруппы. Номера групп в таблице изображаются римскими цифрами.
— Переменная валентность (часто бывает у неметаллов) определяется по формуле: 8 вычесть № группы, в которой находится вещество.
Расшифровка периодов и групп периодической таблицы Менделеева
Каждый элемент имеет свой порядковый (атомный) номер, располагается в определённом периоде и определённой группе.
Периоды
- Малые периоды: первый, второй и третий периоды. В них содержится соответственно 2, 8 и 8 элементов;
- Большие периоды: остальные элементы. В четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент.
В таблице 7 периодов. В каждом содержится определённое число элементов:
1-й период — 2 элемента (малый период),
2-й период — 8 элементов (малый период),
3-й период — 8 элементов (малый период),
4-й период — 18 элементов (большой период),
5-й период — 18 элементов (большой период),
6-й период — 32 элемента (18+14) (большой период),
7-й период — 32 элемента (18+14) (большой период).
Группы и подгруппы
- Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов.
- Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
В Периодической таблице может использоваться разное обозначение групп. Поэтому согласно такому обозначению бывает разная расшифровка групп таблицы менделеева:
- 18 групп, пронумерованных арабскими цифрами.
- 8 групп, пронумерованных цифрами с добавлением букв A или B.
Группы A — это главные подгруппы.
Группы B — это побочные подгруппы в больших периодов. Это только металлы.
IA, VIIIA — по 7 элементов;
IIA — VIIA — по 6 элементов;
IIIB — 32 элемента (4+14 лантаноидов +14 актиноидов);
VIIIB — 12 элементов;
IB, IIB, IVB — VIIB — по 4 элемента.
Римский номер группы, как правило, показывает высшую валентность в оксидах (но для некоторых элементов не выполняется).
Элементы с порядковыми номерами 58–71 (лантаноиды) и 90–103 (актиноиды) вынесены из таблицы и располагаются под ней. Это элементы IIIB группы. Лантаноиды относятся к шестому периоду, а актиноиды — к седьмому.
Элементы главной подгруппы
1 группа главная подгруппа элементов (IA) — щелочные металлы.
Это мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним электроном на внешней оболочке и прекрасно вступают в реакцию.
Литий Li (3), Натрий Na (11), Калий K (19), Рубидий Rb (37), Цезий Cs (55), Франций Fr (87).
2 группа главная подгруппа (IIА) -щелочноземельными металлами.
Имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Кальций Ca (20), Стронций Sr (38), Барий Ba (56), Радий Ra (88).
3 группа главная подгруппа (IIIА).
Все элементы данной подгруппы, за исключением бора, металлы. Главную подгруппу составляют составляют бор, алюминий, галлий, индий и таллий. На внешнем электронном уровне элементов по три электрона. Они легко отдают эти электроны или образуют три неспаренных электрона.
4 группа главная подгруппа (IVА) .
Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы).
5 группа главная подгруппа (VA).
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
6 группа главной подгруппы (VIA) .
Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства.
7 группа главная подгруппа (VIIA) — галогены .
(F, Cl, Br, I, At). Имеют семь электронов на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
8 группа главная подгруппа (VIIIA) — инертные (благородные) газы.
(He, Ne, Ar, Kr, Xe, Rn, Og). У них полностью заполнен внешний электронный уровень. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными». У инертных газов есть способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Элементы побочной подгруппы
Элементы побочных подгрупп кроме лантаноидов и актиноидов — переходные металлы.
Твёрдые (исключение жидкая ртуть), плотные, обладают характерным блеском, хорошо проводят тепло и электричество.
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
3 группа побочная подгруппа (IIIB) шестого и седьмого периодов — лантаноиды и актиноиды.
Для удобства их помещают под основной таблицей.
- Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
- Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Неметаллы
Правый верхний угол таблицы до инертных газов -неметаллы.
Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе.
Кислородные и водородные соединения
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения.
Существует 8 форм кислородных соединений: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4,
где R — элемент группы.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют 4 формы водородных соединений: RH4, RH3, RH2, RH.
Характер соединений: RH — сильнокислый; RH2 — слабокислый; RH3 — слабоосновный; RH4 — нейтральный.
Степан Щипачёв
писал:
Другого ничего в природе нет
Ни здесь, ни там, в космических глубинах:
Всё – от песчинок малых до планет
Из элементов состоит единых.
Как
вы помните, все химические модели делят на предметные и знаковые. К
знаковым моделям относят символы химических элементов, формулы веществ,
уравнения химических реакций. Впервые использование символов химических
элементов предложил шведский химик Йенс Якоб
Берцелиус. Его можно считать отцом химической письменности, как Кирилла и Мефодия считают авторами славянской письменности.

Под
химическим элементом понимают вид одинаковых атомов. Берцелиус предложил
обозначать все химические элементы первой буквой их латинских названий.
Например, кислород имеет латинское название oxygenium, начинается название с
буквы «о», обозначается кислород поэтому буквой «о». Читается также «о».
Латинское название водорода hydrogenium, начинается название с буквы
«Н», читается также «аш». Латинское название углерода
– carboneum,
начинается с буквы «ц», читается «цэ». Название хрома
по латинскому chromium,
а хлора – chlorum,
меди – cuprum.
Названия этих трёх химических элементов начинаются с буквы «с». Поэтому Берцелиус
предложил такие символы записывать не одной, а двумя буквами, то есть первой и
одной из последующих букв. Так хром обозначают Cr (читается «хром»), хлор обозначается
Cl
(читается «хлор»), а медь обозначается Cu (читается «купрум»).

Рассмотрим
названия и символы некоторых химических элементов. Азот имеет латинское
название nitrogenium,
произносится «эн», химический знак N;
алюминий имеет латинское название aluminium, химический знак Al, произносится «алюминий»; водород
имеет латинское название hydrogenium, химический знак Н,
произносится «аш»; железо имеет латинское название ferrum,
обозначается Fe,
читается «феррум»; золото имеет латинское название aurum, пишется Au, произносится «аурум»;
калий имеет латинское название kalium, пишется К, произносится
«калий»; кальций имеет латинское название calcium, химический знак Са, произносится «кальций»; кислород имеет латинское
название oxygenium,
химический знак О, произносится «о»; магний имеет латинское название magnesium, химический знак Mg, произносится «магний»; медь имеет
латинское название cuprum,
химический знак Cu,
произносится «купрум»; натрий имеет латинское
название natrium,
обозначается Na,
произносится «натрий»; ртуть имеет латинское название hydrargyrum,
пишется Hg,
произносится «гидраргирум»; свинец имеет латинское
название plumbum,
пишется Pb,
произносится «плюмбум»; сера имеет латинское название
sulfur,
химический знак S,
произносится «эс»; серебро имеет латинское название argentum, химический знак Ag, произносится «аргентум»;
углерод имеет латинское название carboneum, пишется С, произносится
«цэ»; фосфор имеет латинское название phosphorus, пишется Р, произносится
«пэ»; хлор имеет латинское название chlorum, химический знак Cl, произносится «хлор»; хром имеет
латинское название chromium,
пишется Cr,
произносится «хром»; цинк имеет латинское название zincum, химический знак Zn, произносится «цинк».
Как в
русском языке буквы образуют слова, а слова предложения, так и в химии, знаки
химических элементов образуют химические формулы, а химические формулы –
уравнения химических реакций.
Чтобы
увидеть все химические элементы, следует обратиться к периодической таблице Д.
И. Менделеева.

Некоторые
названия химических элементов обозначают свойства простых веществ. Например: фосфор означает «несущий свет», фтор –
«разрушающий», азот – «безжизненный». Некоторые химические элементы названы в
честь стран. Например: элемент полоний назван в честь
Польши, галлий – Франции, рутений – в честь России. Некоторые элементы названы
в честь планет. Например: теллур – в честь Земли,
селен – в честь Луны, уран – в честь Урана. Часть элементов имеет названия из
мифологии. Так, тантал назван в честь любимого сына Зевса, прометий – в честь
Прометея, ванадий – в честь скандинавской богини Фрейи.
Некоторые химические элементы названы в честь учёных: менделевий – в честь
Менделеева, эйнштейний – в честь Эйнштейна, лоуренсий
– в честь Лоуренса.
В
состав большинства веществ входят атомы не одного химического элемента, а
нескольких. Чтобы изобразить молекулы веществ можно использовать модели
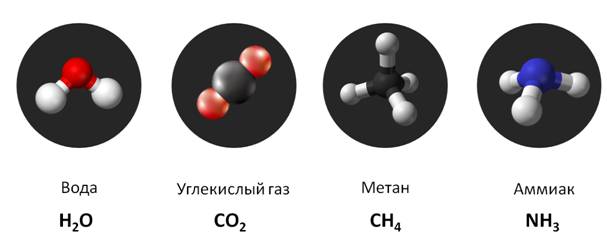
– шарики, которые изображают атомы. Например, с помощью шариков можно
изобразить объёмные модели молекул воды, углекислого газа, метана, аммиака.
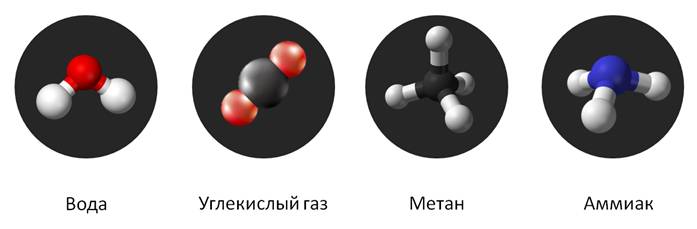
С
помощью изученных символов и индексов записывают химические формулы. Индекс показывает
число атомов данного химического элемента в веществе. Индекс записывается
справа внизу от химического элемента. В нашем случае формула воды – H2O, у водорода индекс 2, а у кислорода
– 1, то есть в состав молекулы воды входят 2 атома водорода и 1 атом кислорода.
Формула углекислого газа CO2,
то есть в составе молекулы 1 атом углерода и 2 атома кислорода. У метана
формула СН4, то есть в его составе 1 атом углерода и 4 атома
водорода. Формула аммиака NH3,
значит в составе молекулы 1 атом азота и 3 атома водорода. Как вы могли
заметить индекс «1» в формуле не записывается.
Поэтому
химическая формула показывает качественный состав вещества, то есть
какие атомы входят в состав этого вещества, а также количественный состав,
то есть сколько атомов каждого химического элемента входит в состав
вещества.
Разберём
количественный и качественный состав HNO3. Качественный состав: в
состав молекулы входят атомы водорода, азота и кислорода. Количественный
состав: в состав молекулы входят 1 атом водорода, 1 атом азота и 3 атома
кислорода.
По
формуле вещества можно определить простым или сложным является данное вещество.
То есть, простое вещество – это вещество, которое состоит из атомов
одного химического элемента, а сложное вещество – это вещество, которое
состоит из атомов разных химических элементов.
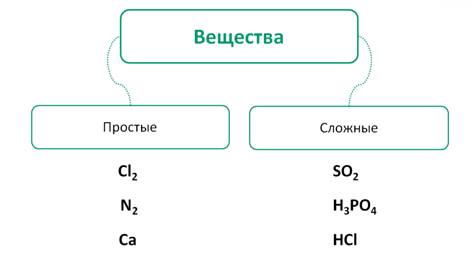
Например,
Cl2,
N2,
Са – это простые вещества, так как состоят из
атомов одного химического элемента, а SO2, H3PO4,
HCl
– это сложные вещества, так как состоят из атомов разных химических элементов.