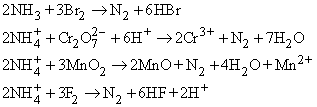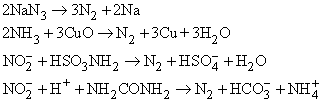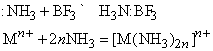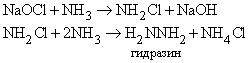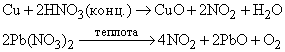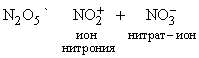Азо́т — элемент главной подгруппы пятой группы второго периода периодической системы химических элементов, с атомным номером 7. Обозначается символом N (лат. Nitrogenium). Простое вещество азот (CAS-номер: 7727-37-9) — достаточно инертный при нормальных условиях двухатомный газ без цвета, вкуса и запаха (формула N2), из которого на три четверти состоит земная атмосфера.
История открытия
В 1772 году Генри Кавендиш провёл следующий опыт: он многократно пропускал воздух над раскалённым углём, затем обрабатывал его щёлочью, в результате получался остаток, который Кавендиш назвал удушливым (или мефитическим) воздухом. С позиций современной химии ясно, что в реакции с раскалённым углём кислород воздуха связывался в углекислый газ, который затем поглощался щёлочью. При этом остаток газа представлял собой по большей части азот. Таким образом, Кавендиш выделил азот, но не сумел понять, что это новое простое вещество (химический элемент). В том же году Кавендиш сообщил об этом опыте Джозефу Пристли.
Пристли в это время проводил серию экспериментов, в которых также связывал кислород воздуха и удалял полученный углекислый газ, то есть также получал азот, однако, будучи сторонником господствующей в те времена теории флогистона, совершенно неверно истолковал полученные результаты (по его мнению, процесс был противоположным — не кислород удалялся из газовой смеси, а наоборот, в результате обжига воздух насыщался флогистоном; оставшийся воздух (азот) он и назвал насыщенным флогистоном, то есть флогистированным). Очевидно, что и Пристли, хотя и смог выделить азот, не сумел понять сути своего открытия, поэтому и не считается первооткрывателем азота.
Одновременно схожие эксперименты с тем же результатом проводил и Карл Шееле.
В 1772 году азот (под названием «испорченного воздуха») как простое вещество описал Даниэль Резерфорд, он опубликовал магистерскую диссертацию, где указал основные свойства азота (не реагирует со щелочами, не поддерживает горения, непригоден для дыхания). Именно Даниэль Резерфорд и считается первооткрывателем азота. Однако и Резерфорд был сторонником флогистонной теории, поэтому также не смог понять, что же он выделил. Таким образом, чётко определить первооткрывателя азота невозможно.
В дальнейшем азот был изучен Генри Кавендишем (интересен тот факт, что он сумел связать азот с кислородом при помощи разрядов электрического тока, а после поглощения оксидов азота в остатке получил небольшое количество газа, абсолютно инертного, хотя, как и в случае с азотом, не смог понять, что выделил новый химический элемент — инертный газ аргон).
Происхождение названия
Азо́т (от др.-греч. ἄζωτος — безжизненный, лат. nitrogenium), вместо предыдущих названий («флогистированный», «мефитический» и «испорченный» воздух) предложил в 1787 году Антуан Лавуазье, который в то время в составе группы других французских учёных разрабатывал принципы химической номенклатуры. Как показано выше, в то время уже было известно, что азот не поддерживает ни горения, ни дыхания. Это свойство и сочли наиболее важным. Хотя впоследствии выяснилось, что азот, наоборот, крайне необходим для всех живых существ, название сохранилось во французском и русском языках.
Существует и иная версия. Слово «азот» придумано не Лавуазье и не его коллегами по номенклатурной комиссии; оно вошло в алхимическую литературу уже в раннем средневековье и употреблялось для обозначения «первичной материи металлов», которую считали «альфой и омегой» всего сущего. Это выражение заимствовано из Апокалипсиса: «Я есмь Альфа и Омега, начало и конец» (Откр.1:8-10). Слово составлено из начальных и конечных букв алфавитов трёх языков — латинского, греческого и древнееврейского, — считавшихся «священными», поскольку, согласно Евангелиям, надпись на кресте при распятии Христа была сделана на этих языках (а, альфа, алеф и зет, омега, тав — AAAZOTH). Составители новой химической номенклатуры хорошо знали о существовании этого слова; инициатор её создания Гитон де Морво отмечал в своей «Методической энциклопедии» (1786) алхимическое значение термина.
Возможно, слово «азот» произошло от одного из двух арабских слов — либо от слова «аз-зат» («сущность» или «внутреннюю реальность»), либо от слова «зибак» («ртуть»)..
На латыни азот называется «nitrogenium», то есть «рождающий селитру»; английское название производится от латинского. В немецком языке используется название Stickstoff, что означает «удушающее вещество».
Получение
В лабораториях его можно получать по реакции разложения нитрита аммония:
NH4NO2 → N2↑ + 2H2O
Реакция экзотермическая, идёт с выделением 80 ккал (335 кДж), поэтому требуется охлаждение сосуда при её протекании (хотя для начала реакции требуется нагревание нитрита аммония).
Практически эту реакцию выполняют, добавляя по каплям насыщенный раствор нитрита натрия в нагретый насыщенный раствор сульфата аммония, при этом образующийся в результате обменной реакции нитрит аммония мгновенно разлагается.
Выделяющийся при этом газ загрязнён аммиаком, оксидом азота (I) и кислородом, от которых его очищают, последовательно пропуская через растворы серной кислоты, сульфата железа (II) и над раскалённой медью. Затем азот осушают.
Ещё один лабораторный способ получения азота — нагревание смеси дихромата калия и сульфата аммония (в соотношении 2:1 по массе). Реакция идёт по уравнениям:
K2Cr2O7 + (NH4)2SO4 = (NH4)2Cr2O4 + K2SO4
(NH4)2Cr2O7 →(t) Cr2O3 + N2↑ + 4H2O
Самый чистый азот можно получить разложением азидов металлов:
2NaN3 →(t) 2Na + 3N2↑
Так называемый «воздушный», или «атмосферный» азот, то есть смесь азота с благородными газами, получают путём реакции воздуха с раскалённым коксом:
O2+ 4N2 + 2C → 2CO + 4N2
При этом получается так называемый «генераторный», или «воздушный», газ — сырьё для химических синтезов и топливо. При необходимости из него можно выделить азот, поглотив монооксид углерода.
Молекулярный азот в промышленности получают фракционной перегонкой жидкого воздуха. Этим методом можно получить и «атмосферный азот». Также широко применяются азотные установки и станции, в которых используется метод адсорбционного и мембранного газоразделения.
Один из лабораторных способов — пропускание аммиака над оксидом меди (II) при температуре ~700 °C:
2NH3 + 3CuO → N2↑ + 3H2O + 3Cu
Аммиак берут из его насыщенного раствора при нагревании. Количество CuO в 2 раза больше расчётного. Непосредственно перед применением азот очищают от примеси кислорода и аммиака пропусканием над медью и её оксидом (II) (тоже ~700 °C), затем сушат концентрированной серной кислотой и сухой щёлочью. Процесс происходит довольно медленно, но он того стоит: газ получается весьма чистый.
Физические свойства
При нормальных условиях азот это бесцветный газ, не имеет запаха, мало растворим в воде (2,3 мл/100г при 0 °C, 0,8 мл/100 г при 80 °C), плотность 1,2506 кг/м³ (при н.у.).
В жидком состоянии (темп. кипения −195,8 °C) — бесцветная, подвижная, как вода, жидкость. Плотность жидкого азота 808 кг/м³. При контакте с воздухом поглощает из него кислород.
При −209,86 °C азот переходит в твердое состояние в виде снегоподобной массы или больших белоснежных кристаллов. При контакте с воздухом поглощает из него кислород, при этом плавится, образуя раствор кислорода в азоте.
Источник: Википедия
Другие заметки по химии
АЗОТ, N (nitrogenium), химический элемент (ат. номер 7) VA подгруппы периодической системы элементов. Атмосфера Земли содержит 78% (об.) азота. Чтобы показать, как велики эти запасы азота, отметим, что в атмосфере над каждым квадратным километром земной поверхности находится столько азота, что из него можно получить до 50 млн. т нитрата натрия или 10 млн. т аммиака (соединение азота с водородом), и все же это составляет малую долю азота, содержащегося в земной коре. Существование свободного азота свидетельствует о его инертности и трудности взаимодействия с другими элементами при обычной температуре. Связанный азот входит в состав как органической, так и неорганической материи. Растительный и животный мир содержит азот, связанный с углеродом и кислородом в белках. Помимо этого, известны и могут быть получены в больших количествах азотсодержащие неорганические соединения, такие, как нитраты (NO3–), нитриты (NO2–), цианиды (CN–), нитриды (N3–) и азиды (N3–).
Историческая справка.
Опыты А.Лавуазье, посвященные исследованию роли атмосферы в поддержании жизни и процессов горения, подтвердили существование относительно инертного вещества в атмосфере. Не установив элементную природу остающегося после сгорания газа, Лавуазье назвал его azote, что на древнегреческом означает «безжизненный». В 1772 Д.Резерфорд из Эдинбурга установил, что этот газ является элементом, и назвал его «вредный воздух». Латинское название азота происходит от греческих слов nitron и gen, что означает «образующий селитру».
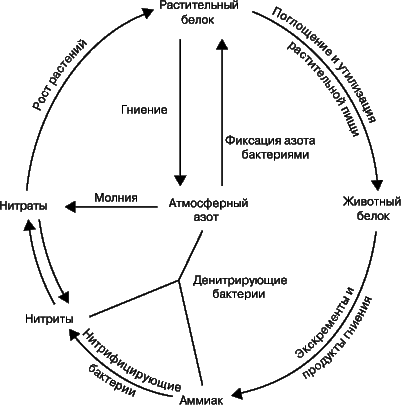
Фиксация азота и азотный цикл.
Термин «фиксация азота» означает процесс связывания атмосферного азота N2. В природе это может происходить двумя путями: либо бобовые растения, например горох, клевер и соя, накапливают на своих корнях клубеньки, в которых бактерии, фиксирующие азот, превращают его в нитраты, либо происходит окисление атмосферного азота кислородом в условиях разряда молнии. С.Аррениус установил, что таким способом фиксируется до 400 млн. т азота ежегодно. В атмосфере оксиды азота соединяются с дождевой водой, образуя азотную и азотистую кислоты. Кроме того, установлено, что с дождем и снегом на каждый гектар земли попадает ок. 6700 г азота; достигая почвы, они превращаются в нитриты и нитраты. Растения используют нитраты для образования растительных белковых веществ. Животные, питаясь этими растениями, усваивают белковые вещества растений и превращают их в животные белки. После смерти животных и растений происходит их разложение, азотные соединения превращаются в аммиак. Аммиак используется двумя путями: бактерии, не образующие нитратов, разрушают его до элементов, выделяя азот и водород, а другие бактерии образуют из него нитриты, которые другими бактериями окисляются до нитратов. Таким образом происходит круговорот азота в природе, или азотный цикл.
Строение ядра и электронных оболочек.
В природе существуют два стабильных изотопа азота: с массовым числом 14 ( содержит 7 протонов и 7 нейтронов) и с массовым числом 15 (
содержит 7 протонов и 8 нейтронов). Их соотношение составляет 99,635:0,365, поэтому атомная масса азота равна 14,008. Нестабильные изотопы азота 12N, 13N, 16N, 17N получены искусственно. Схематически электронное строение атома азота
таково: 1s22s22px12py12pz1. Следовательно, на внешней (второй) электронной оболочке находится 5 электронов, которые могут участвовать в образовании химических связей; орбитали азота могут также принимать электроны, т.е. возможно образование соединений со степенью окисления от (–III) до (V), и они известны. См. также АТОМА СТРОЕНИЕ.
Молекулярный азот.
Из определений плотности газа установлено, что молекула азота двухатомна, т.е. молекулярная формула азота имеет вид NєN (или N2). У двух атомов азота три внешних 2p-электрона каждого атома образуют тройную связь:N:::N:, формируя электронные пары. Измеренное межатомное расстояние N–N равно 1,095 Å. Как и в случае с водородом (см. ВОДОРОД), существуют молекулы азота с различным спином ядра – симметричные и антисимметричные. При обычной температуре соотношение симметричной и антисимметричной форм равно 2:1. В твердом состоянии известны две модификации азота: a – кубическая и b – гексагональная с температурой перехода a ® b –237,39° С. Модификация b плавится при –209,96° С и кипит при –195,78° C при 1 атм (см. табл. 1).
Энергия диссоциации моля (28,016 г или 6,023Ч1023 молекул) молекулярного азота на атомы (N2 2N) равна примерно –225 ккал. Поэтому атомарный азот может образовываться при тихом электрическом разряде и химически более активен, чем молекулярный азот.
Получение и применение.
Способ получения элементного азота зависит от требуемой его чистоты. В огромных количествах азот получают для синтеза аммиака, при этом допустимы небольшие примеси благородных газов.
Азот из атмосферы.
Экономически выделение азота из атмосферы обусловлено дешевизной метода сжижения очищенного воздуха (пары воды, CO2, пыль, другие примеси удалены). Последовательные циклы сжатия, охлаждения и расширения такого воздуха приводят к его сжижению. Жидкий воздух подвергают фракционной перегонке при медленном подъеме температуры. Первыми выделяются благородные газы, затем азот, и остается жидкий кислород. Очистка достигается многократностью процессов фракционирования. Таким методом производят многие миллионы тонн азота ежегодно, преимущественно для синтеза аммиака, который является исходным сырьем в технологии производства различных азотсодержащих соединений для промышленности и сельского хозяйства. Кроме того, очищенную азотную атмосферу часто используют, когда недопустимо присутствие кислорода.
Лабораторные способы.
Азот в небольших количествах можно получать в лаборатории разными способами, окисляя аммиак или ион аммония, например:
Очень удобен процесс окисления иона аммония нитрит-ионом:
Известны и другие способы – разложение азидов при нагревании, разложение аммиака оксидом меди(II), взаимодействие нитритов с сульфаминовой кислотой или мочевиной:
При каталитическом разложении аммиака при высокой температуре тоже можно получить азот:
Физические свойства.
Некоторые физические свойства азота приведены в табл. 1.
| Таблица 1. НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА АЗОТА | |
| Плотность, г/см3 | 0,808 (жидк.) |
| Температура плавления, °С | –209,96 |
| Температура кипения, °С | –195,8 |
| Критическая температура, °С | –147,1 |
| Критическое давление, атма | 33,5 |
| Критическая плотность, г/см3а | 0,311 |
| Удельная теплоемкость, Дж/(мольЧК) | 14,56 (15° С) |
| Электроотрицательность по Полингу | 3 |
| Ковалентный радиус, | 0,74 |
| Кристаллический радиус, | 1,4 (M3–) |
| Потенциал ионизации, Вб | |
| первый | 14,54 |
| второй | 29,60 |
| а Температура и давление, при которых плотности азота жидкого и газообразного состояния одинаковы. б Количество энергии, необходимое для удаления первого внешнего и следующего за ним электронов, в расчете на 1 моль атомарного азота. | |
Химические свойства.
Как уже было отмечено, преобладающим свойством азота при обычных условиях температуры и давления является его инертность, или малая химическая активность. Электронная структура азота содержит электронную пару на 2s-уровне и три наполовину заполненные 2р-орбитали, поэтому один атом азота может связывать не более четырех других атомов, т.е. его координационное число равно четырем. Небольшой размер атома также ограничивает количество атомов или групп атомов, которые могут быть связаны с ним. Поэтому многие соединения других членов подгруппы VA либо вовсе не имеют аналогов среди соединений азота, либо аналогичные соединения азота оказываются нестабильными. Так, PCl5 – стабильное соединение, а NCl5 не существует. Атом азота способен связываться с другим атомом азота, образуя несколько достаточно стабильных соединений, такие, как гидразин N2H4 и азиды металлов MN3. Такой тип связи необычен для химических элементов (за исключением углерода и кремния). При повышенных температурах азот реагирует со многими металлами, образуя частично ионные нитриды MxNy. В этих соединениях азот заряжен отрицательно. В табл. 2 приведены степени окисления и примеры соответствующих соединений.
| Таблица 2. СТЕПЕНИ ОКИСЛЕНИЯ АЗОТА И СООТВЕТСТВУЮЩИЕ СОЕДИНЕНИЯ | |
| Степень окисления | Примеры соединений |
| –III | Аммиак NH3, ион аммония NH4+, нитриды M3N2 |
| –II | Гидразин N2H4 |
| –I | Гидроксиламин NH2OH |
| I | Гипонитрит натрия Na2N2O2, оксид азота(I) N2O |
| II | Оксид азота(II) NO |
| III | Оксид азота(III) N2O3, нитрит натрия NaNO2 |
| IV | Оксид азота(IV) NO2, димер N2O4 |
| V | Оксид азота(V) N2O5, азотная кислота HNO3 и ее соли (нитраты) |
Нитриды.
Соединения азота с более электроположительными элементами, металлами и неметаллами – нитриды – похожи на карбиды и гидриды. Их можно разделить в зависимости от характера связи M–N на ионные, ковалентные и с промежуточным типом связи. Как правило, это кристаллические вещества.
Ионные нитриды.
Связь в этих соединениях предполагает переход электронов от металла к азоту с образованием иона N3–. К таким нитридам относятся Li3N, Mg3N2, Zn3N2 и Cu3N2. Кроме лития, другие щелочные металлы IA подгруппы нитридов не образуют. Ионные нитриды имеют высокие температуры плавления, реагируют с водой, образуя NH3 и гидроксиды металлов.
Ковалентные нитриды.
Когда электроны азота участвуют в образовании связи совместно с электронами другого элемента без перехода их от азота к другому атому, образуются нитриды с ковалентной связью. Нитриды водорода (например, аммиак и гидразин) полностью ковалентны, как и галогениды азота (NF3 и NCl3). К ковалентным нитридам относятся, например, Si3N4, P3N5 и BN – высокостабильные белые вещества, причем BN имеет две аллотропные модификации: гексагональную и алмазоподобную. Последняя образуется при высоких давлениях и температурах и имеет твердость, близкую к твердости алмаза.
Нитриды с промежуточным типом связи.
Переходные элементы в реакции с NH3 при высокой температуре образуют необычный класс соединений, в которых атомы азота распределены между регулярно расположенными атомами металла. В этих соединениях нет четкого смещения электронов. Примеры таких нитридов – Fe4N, W2N, Mo2N, Mn3N2. Эти соединения, как правило, совершенно инертны и обладают хорошей электрической проводимостью.
Водородные соединения азота.
Азот и водород взаимодействуют, образуя соединения, отдаленно напоминающие углеводороды (см. также ОРГАНИЧЕСКАЯ ХИМИЯ). Стабильность азотоводородов уменьшается с увеличением числа атомов азота в цепи в отличие от углеводородов, которые устойчивы и в длинных цепях. Наиболее важные нитриды водорода – аммиак NH3 и гидразин N2H4. К ним относится также азотистоводородная кислота HNNN (HN3).
Аммиак NH3.
Аммиак – один из наиболее важных промышленных продуктов современной экономики. В конце 20 в. США производили ок. 13 млн. т аммиака ежегодно (в пересчете на безводный аммиак).
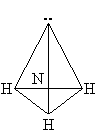
Строение молекулы.
Молекула NH3 имеет почти пирамидальное строение. Угол связи H–N–H составляет 107°, что близко к величине тетраэдрического угла 109°. Неподеленная электронная пара эквивалентна присоединенной группе, в результате координационное число азота равно 4 и азот располагается в центре тетраэдра.
Cвойства аммиака.
Некоторые физические свойств аммиака в сравнении с водой приведены в табл. 3.
| Таблица 3. НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА АММИАКА И ВОДЫ | ||
| Свойство | Аммиак | Вода |
| Плотность, г/см3 | 0,65 (–10° С) | 1,00 (4,0° С) |
| Температура плавления, °С | –77,7 | 0 |
| Температура кипения, °С | –33,35 | 100 |
| Критическая температура, °С | 132 | 374 |
| Критическое давление, атм | 112 | 218 |
| Энтальпия испарения, Дж/г | 1368 (–33° С) | 2264 (100° С) |
| Энтальпия плавления, Дж/г | 351 (–77° С) | 334 (0° С) |
| Удельная электропроводность | 5Ч10–11 (–33° С) | 4Ч10–8 (18° С) |
Температуры кипения и плавления у аммиака намного ниже, чем у воды, несмотря на близость молекулярных масс и сходство строения молекул. Это объясняется относительно большей прочностью межмолекулярных связей у воды, чем у аммиака (такая межмолекулярная связь называется водородной).
Аммиак как растворитель.
Высокая диэлектрическая проницаемость и дипольный момент жидкого аммиака позволяют использовать его как растворитель для полярных или ионных неорганических веществ. Аммиак-растворитель занимает промежуточное положение между водой и органическими растворителями типа этилового спирта. Щелочные и щелочноземельные металлы растворяются в аммиаке, образуя темносиние растворы. Можно полагать, что в растворе происходит сольватация и ионизация валентных электронов по схеме
Синий цвет связывают с сольватацией и движением электронов или с подвижностью «дырок» в жидкости. При высокой концентрации натрия в жидком аммиаке раствор принимает бронзовую окраску и отличается высокой электропроводностью. Несвязанный щелочной металл можно выделить из такого раствора испарением аммиака или добавлением хлорида натрия. Растворы металлов в аммиаке являются хорошими восстановителями. В жидком аммиаке происходит автоионизация
аналогично процессу, протекающему в воде:
Некоторые химические свойства обеих систем сопоставлены в табл. 4.
Жидкий аммиак как растворитель имеет преимущество в некоторых случаях, когда невозможно проводить реакции в воде из-за быстрого взаимодействия компонентов с водой (например, окисление и восстановление). Например, в жидком аммиаке кальций реагирует с KCl с образованием CaCl2 и K, поскольку CaCl2 нерастворим в жидком аммиаке, а К растворим, и реакция протекает полностью. В воде такая реакция невозможна из-за быстрого взаимодействия Ca с водой.
Получение аммиака.
Газообразный NH3 выделяется из солей аммония при действии сильного основания, например, NaOH:
Метод применим в лабораторных условиях. Небольшие производства аммиака основаны также на гидролизе нитридов, например Mg3N2, водой. Цианамид кальция CaCN2 при взаимодействии с водой также образует аммиак. Основным промышленным методом получения аммиака является каталитический синтез его из атмосферного азота и водорода при высоких температуре и давлении:
Водород для этого синтеза получают термическим крекингом углеводородов, действием паров воды на уголь или железо, разложением спиртов парами воды или электролизом воды. На синтез аммиака получено множество патентов, отличающихся условиями проведения процесса (температура, давление, катализатор). Существует способ промышленного получения при термической перегонке угля. С технологической разработкой синтеза аммиака связаны имена Ф.Габера и К.Боша.
Химические свойства аммиака.
Кроме реакций, упомянутых в табл. 4, аммиак реагирует с водой, образуя соединение NH3ЧH2O, которое часто ошибочно считают гидроксидом аммония NH4OH; в действительности существование NH4OH в растворе не доказано. Водный раствор аммиака («нашатырный спирт») состоит преимущественно из NH3, H2O и и малых концентраций ионов NH4+ и OH–, образующихся при диссоциации
Основной характер аммиака объясняется наличием неподеленной электронной пары азота:NH3. Поэтому NH3 – это основание Льюиса, которое имеет высшую нуклеофильную активность, проявляемую в форме ассоциации с протоном, или ядром атома водорода:
Любые ион или молекула, способные принимать электронную пару (электрофильное соединение), будут взаимодействовать с NH3 с образованием координационного соединения. Например:
Символ Mn+ представляет ион переходного металла (B-подгруппы периодической таблицы, например, Cu2+, Mn2+ и др.). Любая протонная (т.е. Н-содержащая) кислота реагирует с аммиаком в водном растворе с образованием солей аммония, таких, как нитрат аммония NH4NO3, хлорид аммония NH4Cl, сульфат аммония (NH4)2SO4, фосфат аммония (NH4)3PO4. Эти соли широко применяются в сельском хозяйстве как удобрения для введения азота в почву. Нитрат аммония кроме того применяют как недорогое взрывчатое вещество; впервые оно было применено с нефтяным топливом (дизельным маслом). Водный раствор аммиака применяют непосредственно для введения в почву или с орошающей водой. Мочевина NH2CONH2, получаемая синтезом из аммиака и углекислого газа, также является удобрением. Газообразный аммиак реагирует с металлами типа Na и K с образованием амидов:
Аммиак реагирует с гидридами и нитридами также с образованием амидов:
Амиды щелочных металлов (например, NaNH2) реагируют с N2O при нагревании, образуя азиды:
Газообразный NH3 восстанавливает оксиды тяжелых металлов до металлов при высокой температуре, по-видимому, благодаря водороду, образующемуся в результате разложения аммиака на N2 и H2:
Атомы водорода в молекуле NH3 могут замещаться на галоген. Иод реагирует с концентрированным раствором NH3, образуя смесь веществ, содержащую NI3. Это вещество очень неустойчиво и взрывается при малейшем механическом воздействии. При реакции NH3 c Cl2 образуются хлорамины NCl3, NHCl2 и NH2Cl. При воздействии на аммиак гипохлорита натрия NaOCl (образуется из NaOH и Cl2) конечным продуктом является гидразин:
Гидразин.
Приведенные выше реакции представляют собой способ получения моногидрата гидразина состава N2H4ЧH2O. Безводный гидразин образуется при специальной перегонке моногидрата с BaO или другими водоотнимающими веществами. По свойствам гидразин слегка напоминает пероксид водорода H2O2. Чистый безводный гидразин – бесцветная гигроскопичная жидкость, кипящая при 113,5° C; хорошо растворяется в воде, образуя слабое основание
В кислой среде (H+) гидразин образует растворимые соли гидразония типа [NH2NH2H]+X–. Легкость, с которой гидразин и некоторые его производные (например, метилгидразин) реагируют с кислородом, позволяет использовать его в качестве компонента жидкого ракетного топлива. Гидразин и все его производные сильно ядовиты.
Оксиды азота.
В соединениях с кислородом азот проявляет все степени окисления, образуя оксиды: N2O, NO, N2O3, NO2 (N2O4), N2O5. Имеется скудная информация об образовании пероксидов азота (NO3, NO4).
Оксид азота(I)
N2O (монооксид диазота) получается при термической диссоциации нитрата аммония:
Молекула имеет линейное строение
N2O довольно инертен при комнатной температуре, но при высоких температурах может поддерживать горение легко окисляющихся материалов. N2O, известный как «веселящий газ», используют для умеренной анестезии в медицине.
Оксид азота(II)
NO – бесцветный газ, является одним из продуктов каталитической термической диссоциации аммиака в присутствии кислорода:
NO образуется также при термическом разложении азотной кислоты или при реакции меди с разбавленной азотной кислотой:
NO можно получать синтезом из простых веществ (N2 и O2) при очень высоких температурах, например в электрическом разряде. В структуре молекулы NO имеется один неспаренный электрон. Соединения с такой структурой взаимодействуют с электрическим и магнитным полями. В жидком или твердом состоянии оксид имеет голубую окраску, поскольку неспаренный электрон вызывает частичную ассоциацию в жидком состоянии и слабую димеризацию в твердом состоянии: 2NO N2O2.
Оксид азота(III)
N2O3 (триоксид азота) – ангидрид азотистой кислоты: N2O3 + H2O 2HNO2. Чистый N2O3 может быть получен в виде голубой жидкости при низких температурах (–20° С) из эквимолекулярной смеси NO и NO2. N2O3 устойчив только в твердом состоянии при низких температурах (т.пл. –102,3° С), в жидком и газообразном состояния он снова разлагается на NO и NO2.
Оксид азота(IV)
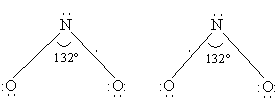
NO2 (диоксид азота) также имеет в молекуле неспаренный электрон (см. выше оксид азота(II)). В строении молекулы предполагается трехэлектронная связь, и молекула проявляет свойства свободного радикала (одна линия соответствует двум спаренным электронам):
NO2 получается каталитическим окислением аммиака в избытке кислорода или окислением NO на воздухе:
а также по реакциям:
При комнатной температуре NO2 – газ темнокоричневого цвета, обладает магнитными свойствами благодаря наличию неспаренного электрона. При температурах ниже 0° C молекула NO2 димеризуется в тетраоксид диазота, причем при –9,3° C димеризация протекает полностью: 2NO2 N2O4. В жидком состоянии недимеризовано только 1% NO2, а при 100° C остается в виде димера 10% N2O4.
NO2 (или N2O4) реагирует в теплой воде с образованием азотной кислоты: 3NO2 + H2O = 2HNO3 + NO. Технология NO2 поэтому очень существенна как промежуточная стадия получения промышленно важного продукта – азотной кислоты.
Оксид азота(V)
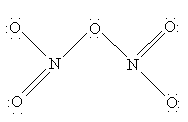
N2O5 (устар. ангидрид азотной кислоты) – белое кристаллическое вещество, получается обезвоживанием азотной кислоты в присутствии оксида фосфора P4O10:
N2O5 легко растворяется во влаге воздуха, вновь образуя HNO3. Свойства N2O5 определяются равновесием
N2O5 – хороший окислитель, легко реагирует, иногда бурно, с металлами и органическими соединениями и в чистом состоянии при нагреве взрывается. Вероятную структуру N2O5 можно представить как
Оксокислоты азота.
Для азота известны три оксокислоты: гипоазотистая H2N2O2, азотистая HNO2 и азотная HNO3.
Гипоазотистая кислота
H2N2O2 – очень нестабильное соединение, образуется в неводной среде из соли тяжелого металла – гипонитрита при действии другой кислоты: M2N2O2 + 2HX 2MX + H2N2O2. При выпаривании раствора образуется белое взрывчатое вещество с предполагаемой структурой H–O–N=N–O–H.
Азотистая кислота
HNO2 не существует в чистом виде, однако водные растворы ее невысокой концентрации образуются при добавлении серной кислоты к нитриту бария:
Азотистая кислота образуется также при растворении эквимолярной смеси NO и NO2 (или N2O3) в воде. Азотистая кислота немного сильнее уксусной кислоты. Степень окисления азота в ней +3 (ее структура H–O–N=O), т.е. она может являться и окислителем, и восстановителем. Под действием восстановителей она восстанавливается обычно до NO, а при взаимодействии с окислителями окисляется до азотной кислоты.
Скорость растворения некоторых веществ, например металлов или иодид-иона, в азотной кислоте зависит от концентрации азотистой кислоты, присутствующей в виде примеси. Соли азотистой кислоты – нитриты – хорошо растворяются в воде, кроме нитрита серебра. NaNO2 применяется в производстве красителей.
Азотная кислота
HNO3 – один из наиболее важных неорганических продуктов основной химической промышленности. Она используется в технологиях множества других неорганических и органических веществ, например, взрывчатых веществ, удобрений, полимеров и волокон, красителей, фармацевтических препаратов и др. См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ.
- Азот
- химический элемент, атомный номер 7, атомная масса 14,0067. В воздухе свободный азот (в виде молекул N2) составляет 78,09%. Немного легче воздуха, плотность 1,2506 кг/м3 при нулевой температуре и нормальном давлении. Температура кипения -195,8°C. Критическая температура -147°C и критическое давление 3,39 МПа. Бесцветный, без запаха и вкуса, нетоксичен, невоспламеняемый, невзрывоопасен и не поддерживающий горение газ в газообразном состоянии при обычной температуре обладает высокой инертностью. Химическая формула — N. В обычных условиях молекула азота двухатомная — N2.
История открытия азота
До сих пор ведутся споры о том, кто был первооткрывателем. В 1772 г. шотландский врач Даниель Резерфорд (Daniel Rutherford) пропуская воздух через раскаленный уголь, а потом через водный раствор щелочи — получил газ, который он назвал «ядовитый газ». Оказалось, что горящая лучинка, внесенная в сосуд, наполненный газом, гаснет, а живое существо в атмосфере этого газа быстро гибнет. Кстати, увидеть опыт с горячей лучинкой можно в видео.
В тоже время британский физик Генри Кавендшин (Henry Cavendish) проводя подобный опыт получил N2назвав его «удушливый воздух», британский естествоиспытатель Джозеф Пристли (Joseph Priestley) дал ему имя «дефлогистированный воздух», шведский химик Карл Вильгельм Шееле (Carl Wilhelm Scheele) — «испорченный воздух».
Окончательное имя «азот» дал французский ученый Антуан Лоран Лавуазье (Antoine Laurent de Lavoisier).
Слово «азот» греческого происхождения и означает «безжизненный».
Азот довольно легко поглощается раскаленным карбидом кальция, образуя при этом важный технический продукт — цианамид кальция и об этом уже писали в статье о получении ацетилена из карбида кальция.
Способы получения азота
Получение N2 в промышленных масштабах основано на производстве его из воздуха путем фракционной перегонки (см. получение азота).
Виды азота
- Жидкий азот
- бесцветная жидкость без запаха с температурой кипения -195,8°C при давлении 101,3 кПа и удельным объемом 1,239 дм3/кг при температуре -195,8°C и давлении 101,3 кПа. Жидкий азот используется как хладагент. Жидкий азот может вызвать обморожение кожи и поражение слизистой оболочки глаз.
- Закись азота
- бесцветный газ, имеет сладковатый вкус и слабый, приятный запах. Свойства этого газа были изучены английским химиком Гемфри Дэви (Humphry Davy) в 1799 году. Интересуясь действием различных газов на организм человека, Дэви обычно испытывал их на себе. При вдыхании закиси азота, он пришел в возбужденное состояние, сопровождаемое смехом. За эти свойства закись азота была названа им — веселящим газом. В дальнейшем было установлено, что при более длительном вдыхании закиси азота наступает потеря сознания. Закись азота — окисел, не дающий кислот, он относится к несолеобразующим окислам.
Закись азота (N2O) не может быть получена из газообразного кислорода и N2, она образуется из азотнокислой соли аммония, которая при осторожном нагревании разлагается на закись азота и воду по реакции:
NH4NO3 = N2O + 2H2O
- Газообразный азот
- относительно инертный по своим свойствам газ без цвета и запаха плотностью 1,25046 кг/м3 при 0°C и давлении 101,3 кПа. Удельный объем газообразного азота равен 860,4 дм3/кг при давлении около 105 Па и температуре 20°C.
В отличие от кислорода, который взаимодействует почти со всеми элементами, встречающимися в природе, газообразный азот при комнатной температуре соединяется с единственным элементом — литием, образуя при этом нитрид лития:
N2 + 6Li = 2Li3N
Но при высоких температурах ряд металлов (титан, молибден и др.) с азотом образуют нитриды, снижающие механические свойства и поэтому его концентрацию в зоне плавления стремятся ограничить.
Применение азота
Азот нашел применение во многих отраслях промышленности и ниже приведен небольшой список:
- для создания инертной атмосферы при производстве, хранении и транспортировке легко окисляемых продуктов;
- при высокотемпературных процессах (например — сварка и резка) обработки металлов, не взаимодействующих с азотом;
- для консервации замкнутых металлических сосудов и трубопроводов.
Применение азота в сварке
N2 является инертным по отношению к меди и ее сплавам (не растворяется в меди и не реагирует с ней) даже при высоких температурах. Азот применяют, как в чистом виде, так и в составе защитного газовой смеси с аргоном Ar (70-90%) + N2 (30-10%) для сварки меди и ее сплавов.
Также газ азот используют для сварки аустенитных нержавеющих сталей — исключительно как компонент защитной газовой смеси с аргоном.
Возникает логичный вопрос: «Если он образует карбиды, какой смысл его использовать для сварки нержавеющих сталей, в составе которых есть карбидообразующие элементы?»
Все дело в том, что даже сравнительно небольшое содержание N2увеличивает тепловую мощность дуги. Именно из-за этого свойства, его чаще всего используют не для сварки, а для плазменной резки.
При сварке полуавтоматом нержавейки добавление небольшого количества азота к смеси аргона с кислородом (95-97,5% Ar, 1% O2, 1,5-3% N2) позволяет добиться равномерной аустенитной структуры в сварных швах. При добавлении азота более 10% начинается обильное выделение дыма, но это не оказывает какого-либо негативного влияния на качество сварного шва нержавеющей стали.
При сварке полуавтоматом малоуглеродистых сталей содержание N2 в газовой смеси более 2% вызывает пористость при сварке в один проход. Концентрация N2 менее 0,5% вызывает пористость в сварном шве при многопроходной сварке.
Применение смеси Ar c высоким содержанием N2 для сварки меди и ее сплавов вызывает большое разбрызгивание металла сварочной ванны.
Вредность и опасность азота
Азот относится к нетоксичным газам, но может действовать как простой асфиксант (удушающий газ). Удушье наступает тогда, когда уровень кислорода в воздухе сокращается на 75% или становится ниже нормальной концентрации.
В больших количествах он очень вреден и опасен для организма человека.
Хранение и транспортировка азота
Выпускают азот по ГОСТ 9293 газообразным и жидким. Для сварки и плазменной резки применяют газообразный 1-го (99,6% N2) и 2-го (99,0% N2) сортов.
Хранят и транспортируют его в сжатом состоянии в стальных баллонах по ГОСТ 949.
Баллоны окрашены в черный цвет и надписью желтыми буквами «АЗОТ» на верхней цилиндрической части.
Характеристики азота
Характеристики N2 указаны в таблицах ниже:
Коэффициенты перевода объема и массы N2 при Т=15°C и Р=0,1 МПа
| Масса, кг | Объем | |
|---|---|---|
| Газ, м3 | Жидкость, л | |
| 1,170 | 1 | 1,447 |
| 0,809 | 0,691 | 1 |
| 1 | 0,855 | 1,237 |
Коэффициенты перевода объема и массы N2 при Т=0°C и Р=0,1 МПа
| Масса, кг | Объем | |
|---|---|---|
| Газ, м3 | Жидкость, л | |
| 1,251 | 1 | 1,548 |
| 0,809 | 0,646 | 1 |
| 1 | 0,799 | 1,237 |
Азот в баллоне
| Наименование | Объем баллона, л | Масса газа в баллоне, кг | Объем газа (м3) при Т=15°C, Р=0,1 МПа |
|---|---|---|---|
| N2 | 40 | 7,37 | 6,3 |
Благодаря информации в таблице можно дать ответы на вопросы, которые часто задают сварщики:
- Сколько литров в баллоне азота?
Ответ: 40 литров - Сколько азота в баллоне 40л?
Ответ: 6,3 м3 или 7,37 кг - Сколько весит баллон с азотом 40 литров
Ответ:
58,5 кг — масса пустого баллона из углеродистой стали согласно ГОСТ 949;
7,37 — кг масса N2 в баллоне;
Итого: 58,5 + 7,37 = 65,87 кг вес баллона с азотом.
Давление азота в баллоне при различной температуре окружающей среды
| Температура окружающей среды | Давление в баллоне, МПа |
|---|---|
| -40 | 11,2 |
| -30 | 11,9 |
| -20 | 12,6 |
| -10 | 13,4 |
| 14,0 | |
| +10 | 14,7 |
| +20 | 15,3 |
| +30 | 15,9 |
Азот (хим. знак N, атомный вес — 14) — один из химических элементов; бесцветный газ, не имеющий ни запаха, ни вкуса; очень мало растворим в воде. Удельный вес его 0,972. Пикте в Женеве и Кальете в Париже удалось сгустить азот, подвергая его высокому давлению при весьма низких температурах. А. заключается в свободном состоянии в атмосферном воздухе в количестве 79 частей по объему, 76,8 частей по весу в смеси его с кислородом и, кроме того, в каменном угле (около 0,75 проц.); он входит в состав аммиака, азотной кислоты, белка, казеина, крови, шерсти и всех органических образований животного и растительного царства; особенно много его в мочевине, в кофеине и теобромине, а также в алкалоидах (хинин, морфин, стрихнин, бруцин, атропин и т. д.). А. неспособен поддерживать ни дыхания, ни горения, трудно вступает в соединение с другими элементами и почти никогда не соединяется с ними прямо. Получить А. можно из воздуха отнятием от последнего кислорода фосфором, сжигая фосфор под колоколом, наполненным воздухом и погруженным в воду. В чистом виде А. получается при пропускании через водный раствор аммиака, хлора или, еще лучше, при кипячении концентрированного раствора азотисто-аммиачной соли, разлагающейся при этом на воду и азот. Важнейшие соединения А. суть: 1) с кислородом: закись азота, окись азота, азотистая кислота, азотноватый ангидрид и азотная кислота; 2) с водородом: аммиак (и органические производные его, как, напр., анилин) и гидроксиламин; 3) с углеродом: циан, или синерод (см. это сл.).
Дополнение[править]
Азот — элемент, в газообразном состоянии является главной составной частью воздуха (см. VI, 878); присутствие его в воздухе указано довольно определенно в 1772 г. Рутерфордом; окончательно оно установлено опытами Пристлея, Шееле, Кавендиша и Лавуазье. Кавендиш нашел, что А. входит в состав азотной кислоты, а Бертоллэ, что он вместе с водородом образует аммиак (см.). Своим названием А. обязан французской комиссии (см. XXXVII, 207), думавшей на основании известных тогда фактов, что удушающее действие А. на животные организмы наиболее для него характерно.
Несомненно, что нет другого элемента с менее удачным названием:
1) равно удушающе действуют на высшие животные организмы [1]) и все другие газы (за исключением кислорода), хотя бы они и не действовали разрушительно на ткани их дыхательных путей (подобно фтору или хлору, напр.);
2) в атмосфере чистого кислорода высшие животные гибнут благодаря быстро наступающим воспалительным процессам, А. же воздуха, уменьшая концентрацию кислорода, умеряет его разрушительное действие (дыхание сопровождается медленным горением) и тем способствует поддержанию жизни;
3) А. представляет непременную составную часть белковых тел и принадлежит таким образом к биогенным элементам (см. XXXVII, 227).
Однако, название А. освящено временем и уже очень прочно укоренилось; этим названием объясняется и знак Az, употребляемый для его обозначения и до сих пор французами; знак N происходит от названия Nitrogène (лат. nitrogenium), предложенного для А. Шапталем (в 1790 г.); он принят во всей нефранцузской химической литературе. Атомный вес А. см. VII, 659. В свободном газообразном состоянии А. имеется в воздухе в количестве 78,06% по объему (или 75,50% по весу — Ледюк); соединенный он находится в почвах: в виде азотнокислых солей, в виде остатков, некогда входивших в состав растений (и животных) белковых и др. (?) азотистых тел (в гумусе, торфе, каменных углях и т. д.), в неизвестном состоянии (азотистые металлы?) в различных минералах (Тильден); затем А. входит в состав аммиака и его солей (имеются в воздухе и почве), в гидразин, азотистоводородную кислоту, гидроксиламин, в цианистые соединения и в многочисленные, как искусственные, так и естественные органические соединения (амины, амиды, имины, имиды, глицины, нитрилы; азо-, диазо-, гидразо- и азоксисоединения; альд- и кетоксимы [см. Изонитрозосоединения]; нитро- и нитрозосоединения; алкалоиды и другие азотсодержащие гетероциклические соединения [см. XXXVIII, 174], и наконец, многочисленные белковые тела). Невозможно добыть А. в чистом состоянии из воздуха (удалением из последнего углекислого газа, паров воды и кислорода), так как вместе с А. остаются: аргон (см.) и спутники последнего: гелий, неон, криптон и ксенон (см.), и неизвестен метод отделения их от А., потому для получения химически чистого А. приходится прибегать к выделению его из химических соединений.
Для этого можно:
1) отнимать водород от водородистых соединений А.;
2) отнимать кислород от его кислородных соединений;
3) вызывать разложение с выделением А. некоторых его органических соединений.
По первому способу А. получается:
1) при пропускании аммиака над нагретой окисью меди (Гаркорт и Лёптон):
2NH3 + 3СuО = N2 + 3H2O + 3Сu;
получающийся газ должен быть освобожден от образующихся при этом отчасти окислов А. пропусканием над раскаленной металлической медью, а от оставшегося неизмененным аммиака и паров воды пропусканием через серную кислоту и над фосфорным ангидридом;
2) при действии хлора на водный раствор аммиака в избытке:
3Cl2 + 8NH3 = N2 + 6NH4Cl
(Фуркруа); получающийся газ содержит еще кислород (Андерсон) и должен быть очищен по-предыдущему; способ неудобен ввиду возможности образования взрывчатого хлористого А.;
3) при действии белильной соли на сернокислый аммоний в водном растворе (Маршан, Кальверт, Нейман, Лунге); если белильная соль спрессована в кубиках, то для добывания А. может быть применен аппарат Киппа; и здесь возможно, однако, образование хлористого А.; по всей вероятности, газ не химически чист;
4) при действии крепкого раствора NH4Cl на сильно щелочной раствор NaBrO (полученный прибавлением Br2 к водному NaOH на холоду):
3NaBrO + 2NH4Cl = N2 + 3NaBr + 3Н2O + 2НСl (?);
реакция идет быстро и бромистого А. не получается;
5) при действии бромноватистого щелока на мочевину:
N2H4CO + 3NaBrO = N2 + СО2 + 2Н2О + 3NaBr;
газ содержит между прочим закись азота (Ралей);
6) при нагревании двухромовокалиевой соли с нашатырем:
Cr2O7K2 + 2NH4Cl = 2KCl + Cr2O3 + 4H2O + N2
(Леви, Рамон де Луна); газ освобождают от кислорода (окислы А.), пропуская его над накаленной медью. (В. Мейер);
7) при нагревании гидрата гидразина (см. VIII, 637) с окисью ртути (Лобри де Брюэн):
N2H4.H2O + 2HgO = N2 + 3H2О + 2Hg
[неизвестно, насколько чист такой А.];

2NO + 2Cu = N2 + 2CuO;
9) при одновременном пропускании над нагретой медью аммиака и окиси А. (или кислорода):
6NO + 4NH3 + Cu = 5N2 + 6Н2О + Сu
(Лёптон; см. XIV, 710);
10) при нагревании азотистоаммиачной соли:
(NH4)NO2 = N2 + 2H2O,
или, что удобнее, смеси крепких растворов азотистокалиевой соли и нашатыря (Корренвиндер):
KNO2 + NH4Cl = KCl + N2 + 2H2O (ср. ниже);
11) при нагревании диазосолей неорганических кислот (см. X, 734) с водою, особенно в присутствии закисных соединений меди или металлической меди (Зандмейер, Гаттерманн, Тобиас), напр.:
C6H5N2Cl + H2O = C6H5(OH)[фенол] + N2 + НСl.
Из перечисленных реакций для добывания А. пригодны: разложение азотистоаммиачной соли и диазосоединений (?). В первом случае нагревают раствор 1 части азотистонатриевой соли, 1—2 серноаммонийной (употребление солей других кислот повышает содержание в А. его окиси — NO) и 1 ч. хромокалиевой соли; газ промывают раствором, который получается смешением 5 об. насыщенного при обыкн. темп. раствора двухромовокалиевой соли и 1 об. крепкой серной кисл. (такой раствор окисляет NO в азотную кисл., но не выделяет в условиях опыта свободного кислорода — Knorre, «Chem. Ind.», 1902, там же литература предмета). Во втором — исходят из чистой кристаллической сернокислой соли диазобензола (напр.); получающийся А. должен быть промыт едкой щелочью и высушен; вполне ли он лишен окислов А., неизвестно. О трудностях получения спектроскопически чистого А. см. Threlfall, «Phil. Mag.» [5], 35, 1. Всех случаев образования А. нельзя перечислить; достаточно упомянуть, что они наблюдались:
1) при действии водорода в присутствии платинированного асбеста на окись и закись A.:
2NO + 2H2 = N2 + 2H2O и N2O + H2 = N2 + H2O
(Кнорре и Арндт); одновременно образуется аммиак (Кл. Винклер);
2) при действии йодопроизводного азотистоводородной кисл. на ее серебряную соль:
N3J + AgN3 = AgJ + 3N2 (Ганч);
3) при действии воды и щелочи (на свету) на йодоаммиак:
N2H3J3 = N2 + 3HJ (Чатэуей и Ортон);
4) при окислении гидроксиламина (см.) целым рядом окислителей (HNO3, МnО2, HMnO4, H2CrO4, CuSO4, HgCl2, Н2О2 и т. д., Кнорре и Арндт);
5) при электролизе гидразина и его солей (Szarvasy);
6) при действии хлорноватистых солей на желатин, альбумин, шерсть, шелк и т. п. (Кальверт);
7) при горении и при детонации всех взрывчатых азотсодержащих смесей (порох дымный и др., см. VI, 176—206), нитросоединений, азотнокислых эфиров и пр. (разновидности бездымных порохов, гремучая ртуть и т. п.);

Впервые биологическое восстановление азотнокислых солей констатировано Дегереном с Маккенем и Шлёзингом; вопрос изучался многими исследователями (Тайон и Дюпти, Вагнер, Брэаль, Гримберт, Пэркс, Врублевский); Бухнер и Рапп («Berl. Ber.», 34, 1526 [1901]), нашедшие, что отжатый от дрожжей сок (стерилизованный) выделяет в присутствии азотистокислых солей довольно большие количества А., сводят это явление на взаимодействие азотистокислых солей с аминокислотами или другими аминопроизводными, так как уже Бешан и Шютценбергер показали, что в водной вытяжке дрожжей имеются тирозин (см.) и лейцин (см.); тою же реакцией объясняется, по их мнению, и выделение А. из азотистых удобрений (навоза), на каковое особенно обращал внимание сельских хозяев Дегерен, наблюдавший при брожении навоза понижение содержания А. в нем на 13,4%. При обыкн. условиях А. бесцветный газ без вкуса и запаха; два последних отрицательных признака, очевидно, обусловлены его полнейшей химической индифферентностью к нервным тканям дыхательных путей и языка. Вес литра при 0 °C и 760 мм = 1,2505 (Райлей). О цвете и спектре А. в Гейслеровых трубках см. работы Плюккера и Гитторфа, Ангстрема, Талена, Шустера, Вюльнера и Деландра. О строгом подчинении А. (с 1% аргона!) при давлениях от 0,011 мм до 1,49 мм ртути закону Бойля — работа Райлея (1901). Отступления от этого закона при больших давлениях (от 39,359 мм до 181,985 мм ртутного столба) изучены Кальетэ (1879), а затем Амага (1893) в очень широких пределах (до 3000 атм.); к сожалению, все эти данные относятся к так наз. «атмосферному» А. (с 1% аргона) и потому, несомненно, ошибочны не только количественно, но, может быть, и качественно. При — 146 °C (Ольшевский), — 146,25° (Врублевский) и 35 (Ольшевский) — 32,29 атм. (Врублевский) А. («атмосферный») переходит из газообразного в парообразное состояние; кривая давления насыщенного пара «химического» А. изучена Бэли («Рhil. Mag.», 1900); т. кип. чистого А. (по Бэли) — 195,4°; темп. пл. А. — 214 °C, давление при «тройной» точке — 60 мм ртути (Ольшевский). Коэффициент светопреломления «химического» А. = 1,0163 (воздух — 1; Рамзей и Траверс, «Zeit. ph. ch.», 1898) [2]). Теплоемкость А. («атмосферного») изучали: Малляр и Ле-Шателье («С. R.», 1881), Вьейль (ib., 1883) и Бертело и Вьейль (ib., 1884). Растворимость изучена Винклером («В. В.», 1891), Брауном («Z. ph. Ch.», 1900) и Юстом (ib., 1901). По Винклеру, растворимость А. в воде: при 0° — 0,02334; при 20° — 0,01507; при 40° — 0,01097; при 60° — 0,00822; при 80° — 0,00510. Что касается химического характера, то есть физико-химической роли А. в системах из двух и более независимых слагаемых (двух «не зависимых друг от друга тел», см. Правило фаз, XXIV, 852), то при обыкн. условиях темп. и давл. эта роль характеризуется почти исключительно отрицательными признаками: только металлическим литием А. поглощается при обыкн. темп. с образованием азотистого лития — Li3N2 (Деландр); по отношению ко всем другим простым и сложным телам он, насколько известно, химически индифферентен. При высоких температурах или при электрических разрядах это отношение меняется и А. оказывается энергичным элементом, образующим иногда очень постоянные соединения. Так, уже Кавендиш нашел, что при горении гремучей смеси, содержащей А., образующаяся вода обладает кислой реакцией, благодаря образованию азотной (азотистой ?) кислоты (см. Флогистон, XXXVI, 143); если водород при этом находится в избытке, то вместо азотной кислоты образуется некоторое количество аммиака (де Соссюр); образование последнего наблюдено и Бертело при сжигании железа или цинка в калориметрической бомбе (?); П. и А. Тенары установили образование аммиака из смеси А. с водородом под влиянием электрических искр (реакция изучалась потом Г. Сент-Клер Девиллем). Об условиях соединения А. с кислородом см. подробнее Горение и Азотная кисл. (доп.). Соединение с углеродом (с углеродистыми металлами ?) имеет место при температуре доменных печей, судя по образующимся в них цианистым металлам. О соединениях А. с другими металлоидами см. частные описания последних. С галоидами А. не соединяется непосредственно, но под влиянием тихого разряда на смеси А., кислорода и хлора образуются белые, легко расплывающиеся на воздухе кристаллы, распадающиеся при 105° с выделением бурых паров; состав их N4Cl2O15 (по всей вероятности = 2N2О4 + Сl2О7; Готфейль и Шаппюи). Бор горит при нагревании (до 1000 °C) в атмосфере А., образуя азотистый бор (Муассан); кремний реагирует, по-видимому, при более низкой темп. (Вёлер и С.-Клер Девилль). Гораздо легче реагируют металлы; об отношении лития см. выше (Уврар, Деландр); магний (Гейтер и Бриглеб, С.-Клер Девилль и Карон, Россель), барий и стронций (Гейтер, Гюнц, Макэн) горят при нагревании в А. до температуры ниже красного каления; поглощение А. железом и алюминием несомненно (Буссенго, Фреми, Буи, Улльгрен, Россель); азотистые соединения образуют уран, торий, празеодимий и неодимий (Myacсан), торий, церий, лантан и самарий (Матиньон). По-видимому, все соединения А. с металлами относятся к типу аммиака, так как они выделяют его или при действии воды (соединения щелочных и щелочноземельных металлов), или же при действии кислот. Бертело показал, что под влиянием тихого разряда А. медленно фиксируется многими органическими соединениями, но характер большинства последних до сих пор не выяснен и нельзя сказать о них ничего определенного. Основываясь на образовании А. при нагревании азотистоаммиачной соли Стерри Гэнт («С. R.», 1862) высказал убеждение, что А., как простое тело, представляет нитрил (см.) азотистой кислоты; такой взгляд возможен, но ни одна реакция нитрилов пока не разработана экспериментально для А. — До сих пор не установлено с точностью, существуют ли какие-нибудь аллотропические (см. Изомерия) видоизменения А. Наблюдение J. Thomson’a и Threlfall’a («R. Soc. Рrос.», 40) над сокращением объема А. под давлением 20 мм при пропускании электрических искр, по-видимому, взято Threlfall’ом назад; что же касается наблюдений Teudt’a («Zeitschr. ph. Ch.», 1898) над изменением коэффициента расширения «атмосферного» А. выше 350 °C и отсутствия такого изменения для «химического» А., то его нельзя считать столь решительным, как это предполагает сам автор. О качественном открытии А. в органических соединениях см. Органический анализ (XXII, 101), о количественных методах определения см. Нитрометрия и Нитрометр.
В газообразном состоянии А. обыкновенно характеризуется отрицательными реакциями (газ не горит, не мутит известковой воды и тушит зажженную лучину — отличие от водорода и углекислого газа), но, несомненно, что его можно характеризовать и положительными реакциями, а именно — образованием окислов азота по Кавендишу, образованием синильной кислоты при пропускании электрических искр через смесь А. и ацетилена:
С2Н2 + N2 = 2NCH,
по Бертело, и наконец, образованием Mg3N2 или Ca3N2 (Гейтер, Рамзай, Макэн, Муассан); для получения свободного кальция можно в последнем случае нагревать смесь негашеной извести с магнием. Применения А. пока носят лабораторный характер, а именно, он употребляется обыкновенно для создания при различных реакциях так назыв. «индифферентной» атмосферы. О технических попытках утилизации «атмосферного» А. см. Азотная кислота (доп.) и Цианистые металлы.
Примечания[править]
- ↑ На растения и на многие микроорганизмы газообразный А. не действует убивающим образом, на анаэробные микроорганизмы таким образом действует кислород воздуха.
- ↑ Работа интересна в том отношении, что в ней авторы отрицают аддитивность (см. Аддитивные свойства) для коэффициентов светопреломления в газовых смесях.
Природный азот состоит из стабильных нуклидов14N (содержание в смеси 99, 635% по массе) и 15N. Конфигурация внешнего электронного слоя 2s22р3. Радиус нейтрального атома азота 0, 074 нм, радиус ионов: N3- — 0, 132, N3+ — 0, 030 и N5+ — 0, 027 нм. Энергии последовательной ионизации нейтрального атома азота равны, соответственно, 14, 53, 29, 60, 47, 45, 77, 47 и 97, 89 эВ. По шкале Полинга электроотрицательность азота 3, 05.
Открыт в 1772 шотландским ученым Д. Резерфордом в составе продуктов сжигания угля, серы и фосфора как газ, непригодный для дыхания и горения («удушливый воздух») и в отличие от CO2 не поглощаемый раствором щелочи. Вскоре французский химик А. Л. Лавуазье пришел к выводу, что «удушливый» газ входит в состав атмосферного воздуха, и предложил для него название «azote» (от греч. azoos — безжизненный). В 1784 английский физик и химик Г. Кавендиш установил присутствие азота в селитре (отсюда латинское название азота, предложенное в 1790 французским химиком Ж. Шанталем).
В природе свободный (молекулярный) азот входит в состав атмосферного воздуха (в воздухе 78, 09% по объему и 75, 6% по массе азота), а в связанном виде — в состав двух селитр: натриевой NaNO3 (встречается в Чили, отсюда название чилийская селитра) и калиевой KNO3 (встречается в Индии, отсюда название индийская селитра) — и ряда других соединений. По распространенности в земной коре азот занимает 17-е место, на его долю приходится 0, 0019% земной коры по массе. Несмотря на свое название, азот присутствует во всех живых организмах (1-3% на сухую массу), являясь важнейшим биогенным элементом. Он входит в состав молекул белков, нуклеиновых кислот, коферментов, гемоглобина, хлорофилла и многих других биологически активных веществ. Некоторые, так называемые азотфиксирующие, микроорганизмы способны усваивать молекулярный азот воздуха, переводя его в соединения, доступные для использования другими организмами (см. Азотфиксация). Превращения соединений азота в живых клетках — важнейшая часть обмена веществ у всех организмов.
В промышленности азот получают из воздуха. Для этого воздух сначала охлаждают, сжижают, а жидкий воздух подвергают перегонке (дистилляции). Температура кипения азота немного ниже (−195, 8 °C), чем у другого компонента воздуха — кислорода (−182, 9 °C), поэтому при осторожном нагревании жидкого воздуха азот испаряется первым. Потребителям газообразный азот поставляют в сжатом виде (150 атм. или 15 МПа) в черных баллонах, имеющих желтую надпись «азот». Хранят жидкий азот в сосудах Дьюара.
В лаборатории чистый («химический») азот получают, добавляя при нагревании насыщенный раствор хлорида аммония NH4Cl к твердому нитриту натрия NaNO2:
NaNO2 + NH4Cl = NaCl + N2 + 2H2O.
Можно также нагревать твердый нитрит аммония:
NH4NO2 = N2 + 2H2O.
Плотность газообразного азота при 0 °C 1, 25046 г/дм3, жидкого азота (при температуре кипения) — 0, 808 кг/дм3. Газообразный азот при нормальном давлении при температуре –195, 8 °C переходит в бесцветную жидкость, а при температуре –210, 0 °C — в белое твердое вещество. В твердом состоянии существует в виде двух полиморфных модификаций: ниже –237, 54 °C устойчива форма с кубической решеткой, выше — с гексагональной.
Критическая температура азота –146, 95 °C, критическое давление 3, 9МПа, тройная точка лежит при температуре –210, 0 °C и давлении 125, 03 гПа, из чего следует, что азот при комнатной температуре ни при каком, даже очень высоком давлении, нельзя превратить в жидкость.
Теплота испарения жидкого азота 199, 3 кДж/кг (при температуре кипения), теплота плавления азота 25, 5 кДж/кг (при температуре –210 °C).
Энергия связи атомов в молекуле N2 очень велика и составляет 941, 6 кДж/моль. Расстояние между центрами атомов в молекуле 0, 110 нм. Это свидетельствует о том, что связь между атомами азота тройная. Высокая прочность молекулы N2 может быть объяснена в рамках метода молекулярных орбиталей. Энергетическая схема заполнения молекулярных орбиталей в молекуле N2 показывает, что электронами в ней заполнены только связывающие σ- и π-орбитали. Молекула азота немагнитна (диамагнитна).
Из-за высокой прочности молекулы N2процессы разложения различных соединений азота (в том числе и печально знаменитого взрывчатого вещества гексогена) при нагревании, ударах и т. д. приводят к образованию молекул N2. Так как объем образовавшегося газа значительно больше, чем объем исходного взрывчатого вещества, гремит взрыв.
Химически азот довольно инертен и при комнатной температуре реагирует только с металлом литием с образованием твердого нитрида лития Li3N. В соединениях проявляет различные степени окисления (от –3 до +5). С водородом образует аммиак NH3. Косвенным путем (не из простых веществ) получают гидразин N2H4 и азотистоводородную кислоту HN3. Соли этой кислоты — азиды. Азид свинца Pb(N3)2 разлагается при ударе, поэтому его используют как детонатор, например, в капсюлях патронов.
Известно несколько оксидов азота. С галогенами азот непосредственно не реагирует, косвенными путями получены NF3, NCl3, NBr3 и NI3, а также несколько оксигалогенидов (соединений, в состав которых, кроме азота, входят атомы и галогена, и кислорода, например, NOF3).
Галогениды азота неустойчивы и легко разлагаются при нагревании (некоторые — при хранении) на простые вещества. Так, NI3 выпадает в осадок при сливании водных растворов аммиака и иодной настойки. Уже при легком сотрясении сухой NI3 взрывается:
2NI3 = N2 + 3I2.
Азот не реагирует с серой, углеродом, фосфором, кремнием и некоторыми другими неметаллами.
При нагревании азот реагирует с магнием и щелочноземельными металлами, при этом возникают солеобразные нитриды общей формулы М3N2, которые разлагаются водой с образованием соответствующих гидроксидов и аммиака, например:
Са3N2 + 6H2O = 3Ca(OH)2 + 2NH3.
Аналогично ведут себя и нитриды щелочных металлов. Взаимодействие азота с переходными металлами приводит к образованию твердых металлоподобных нитридов различного состава. Например, при взаимодействии железа и азота образуются нитриды железа состава Fe2N и Fe4N. При нагревании азота с ацетиленом C2H2 может быть получен цианистый водород HCN.
Из сложных неорганических соединений азота наибольшее значение имеют азотная кислота HNO3, ее соли нитраты, а также азотистая кислота HNO2 и ее соли нитриты.
В промышленности газ азот используют главным образом для получения аммиака. Как химически инертный газ азот применяют для обеспечения инертной среды в различных химических и металлургических процессах, при перекачке горючих жидкостей. Жидкий азот широко используют как хладагент, его применяют в медицине, особенно в косметологии. Важное значение в поддержании плодородия почв имеют азотные минеральные удобрения.
- Справочник азотчика. М., 1969.
- Химическая энциклопедия / Гл. ред. И. Л. Кнунянц. М., 1988. Т. 1.
- Некрасов Б. В. Основы общей химии. М., 1973.
- Проблемы фиксации азота. Неорганическая и физическая химия. М., 1982.